言語:
- サービス
- AI

- 業界

コンテンツ サービス
- 技術文書の作成
- トレーニングおよび eラーニング
- 財務報告書
- デジタル マーケティング
- SEO およびコンテンツの最適化
翻訳サービス
- 動画ローカリゼーション
- ソフトウェア ローカリゼーション
- Web サイト ローカリゼーション
- 規制対象企業向けの翻訳
- 通訳
- ライブ イベント
テスティング サービス
- 機能 QA およびテスト
- 互換性テスト
- 相互運用性テスト
- パフォーマンス テスト
- アクセシビリティ テスト
- UX/CX テスティング
ソリューション
- 翻訳サービス モデル
- 機械翻訳
- Smart Onboarding™
ライオンブリッジのナレッジ ハブ
- 良好な患者アウトカム
- ローカリゼーションの未来
- 最先端免疫学事情
- 新型コロナウイルス (COVID-19) 言語リソース センター
- ディスラプション シリーズ
- 患者エンゲージメント
- ライオンブリッジのインサイト
言語を選択する:
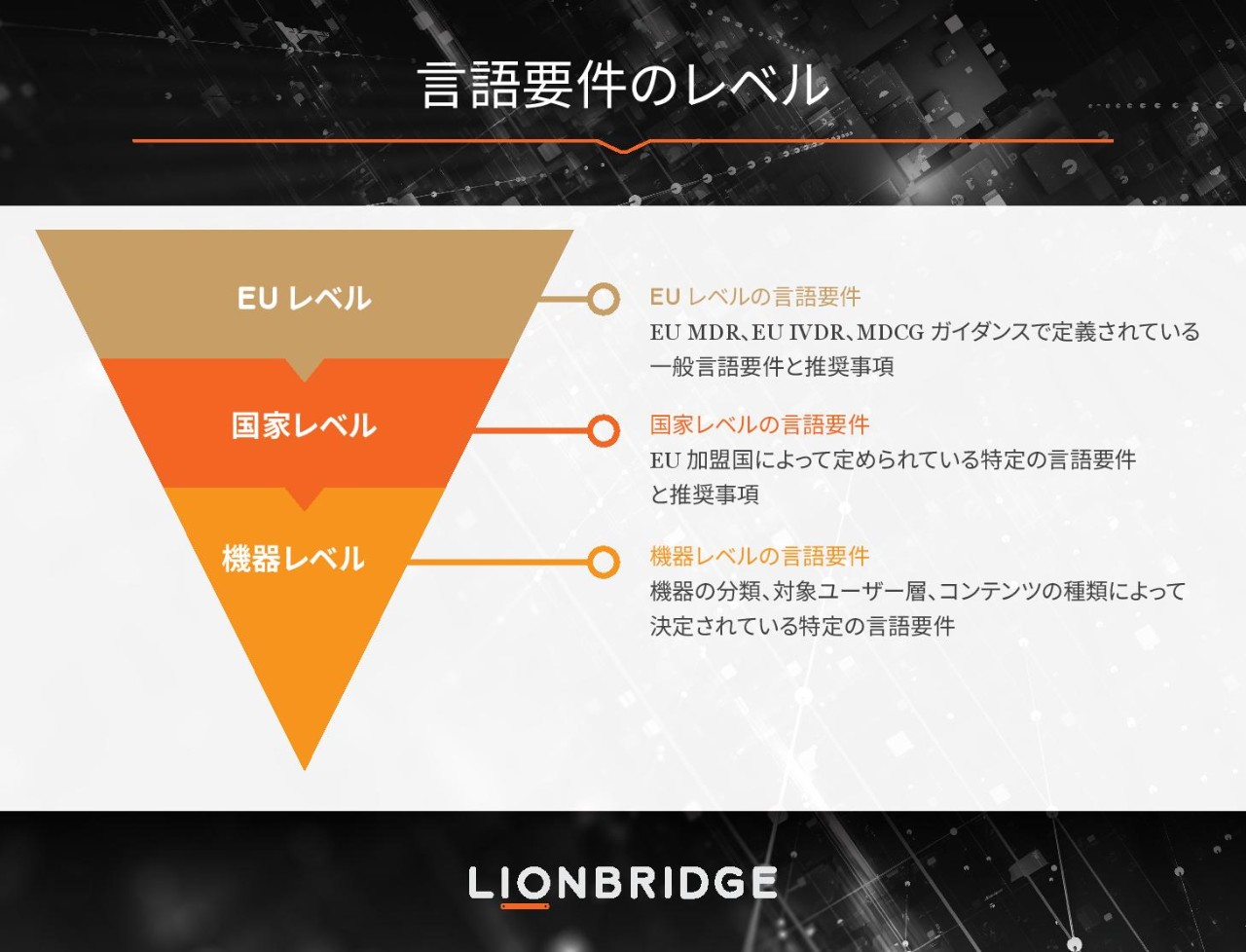
2017 年に EUR-Lex (EU 法データベース) に公開された 2 件の新しい欧州連合規制は、欧州市場で医療機器の販売を計画していた医療機器メーカーに大きな衝撃を与えました。MDR および IVDR は、1990 年代に制定された古い医療機器指令に取って代わる規制です。2022 年 5 月 26 日の IVDR の適用開始日をもって、この新しい両規制の移行期間が終了しました。例外としてさらなる猶予期間の間、市場に残るごく一部の機器もありますが、これらの規制は現在、全面的に効力を発揮しています。
また、2022 年 5 月 26 日は、MDR の適用開始から 1 年を迎える日に当たります。昨年 1 年間、ライオンブリッジは医療技術分野のお客様と連携し、これらの新しい改革の規制要件によって発生した言語面の課題に対応するために、適切で柔軟性の高いソリューションを模索してきました。このイニシアチブはまだ始まったばかりですが、お客様が翻訳を一元化し、機器のライフサイクル全体にわたって言語資産をより活用できるよう尽力しています。

どちらの規制も、メーカーが機器ポートフォリオのライフサイクル全体にわたって管理を行い、機器のパフォーマンスと安全性を EUDAMED データベースに一般公開することを義務付けています。医療技術メーカーにとって今こそ、デバイス ポートフォリオ全体の言語戦略をしっかりと見直すまたとない機会です。
MDR と IVDR により、メーカー各社はコンテンツ面でも言語面でも課題を抱え、負担を感じています。この作業負荷の増加は、いずれの機器についてもライフサイクル全体に適用される新しい文書要件が追加されたこと、また EU 市場で提供する医療技術の透明性に対する新しい要件が追加されたことが要因です。
当社では、当社の MDR ブログ記事シリーズを通して、メーカーが言語面の課題に対処する方法に関する当社の見解と推奨事項を継続的に示してきました。また、当社のインサイトを IVDR にも拡大し、IVDR に関するホワイトペーパーも公開しています。

当社はこれまで、メーカーが自社の機器に関して開発や設計管理にかかわる活動とともに、翻訳や言語資産に関する計画を進めることを推奨してきました。
EU ではさまざまな言語が使用されています。古い EU 指令が規制に格上げされたのは主に整合化を図るためでしたが、言語は依然として各加盟国の所轄官庁が決定する国内要件として残されています。当社では、機器ポートフォリオ全体で言語活動を管理して最適化できるよう、メーカーの皆様には言語の評価を段階的な工程として組み込むことをお勧めしています。