语言:
- 我们的服务范围
- 生成式人工智能 (GenAI)

- 行业
- LANGUAGE CLOUD™

- 公司简介

内容服务
- 技术文献写作
- 培训和在线学习
- 财务报告
- 数字营销
- 搜索引擎优化 (SEO) 和内容优化
翻译服务
- 视频本地化
- 软件本地化
- 受监管内容翻译与本地化
- 口译
- 现场活动
- 网站本地化
测试服务
- 功能 QA 和测试
- 兼容性测试
- 互操作性测试
- 性能测试
- 辅助功能测试
- UX/CX 测试
解决方案
- 翻译服务模式
- 机器翻译
- Smart Onboarding™
Lionbridge 知识中心
- 改善患者治疗结果
- 本地化的未来
- 将创新想法转化为免疫实践
- 新冠肺炎疫情资源中心
- 颠覆系列
- 患者配合度
- Lionbridge 见解
选择语言:
患者自述效果 (PRO) 评估已成为将患者意见纳入医疗产品开发的重要工具。从早期开发到临床试验和观察性研究,在整个产品生命周期内都可以收集 PRO 数据。PRO 可作为以下内容的依据:
- 纳入标准
- 基准评估
- 疗效评估
- 临床试验和/或批准后安全性研究中的安全性评估
美国食品和药物管理局 (FDA) 和欧洲药品管理局 (EMA) 等监管机构,将 PRO 归为“患者体验数据 (PED)”的大类。PED 可反映患者在患病过程中的感受、观点、需求和优先事项。这些机构利用其战略计划和指导文件,来推动实现将 PED 作为产品开发和监管决策的重要助力因素。
监管决策中的 PED
然而,要让监管机构和该行业在 PED 使用方面保持完全一致,任重而道远。尽管 FDA 大力提倡使用 PED,但据报道,上市授权申请者、患者和护理人员不太清楚该机构如何使用此类数据,在审查新药和新生物制品申请时做出决策。同样,EMA 主持的一次多学科研讨会揭示了该行业利益相关者的看法,即欧盟 (EU) 监管机构不会欣然接纳 PED,亦不认为这些数据富有价值。
正因如此,该行业的利益相关者不愿将 PED 算作上市授权申请的协助材料。此后,EMA 澄清称,他们“乐于接纳并迫切希望”将 PED 作为上市授权申请材料。
为了能够生成充分且可靠的相关 PED,我们需要提高使用此类数据做出监管决策的透明度。要实现这一透明度,就需要进一步协调统一各司法管辖区针对国际多中心试验中所收集 PED 的法规要求。正如欧洲制药工业协会联合会 (EFPIA) 所建议的那样,ICH M4E 能使全球在这些要求上达成妥善一致。

收集患者自述效果数据的更优策略
虽然从总体来看,监管的不确定性会大大影响医疗产品开发,但它不太可能是试验参与者的当务之急。他们眼下面临更紧急的问题 — 受访者承受的沉重负担,而造成这一负担的原因可能是应用 PRO。这些不同因素或将决定/导致:
- 试验中的 PRO 问卷份数
- PRO 评估频次
- PRO 问卷的问题数量/完成时间
- 试验所用 PRO 问卷的问题重复或类似
- 语言不清晰
- PRO 数据收集的格式或模式不便。
预测和减轻受访者负担至关重要,有助于试验所执行的 PRO 数据收集策略大获成功。Aiyegbusi 及其同事简要总结了减轻受访者负担的关键方法要素。这些要素包括:
- 选择在试验中使用 PRO 的明确理由
- 考虑病情性质和试验干预措施效果的评估时间表
- 在适当情况下,通过技术协助完成 PRO
- 尽早让患者参与和配合做出关于选择和交付 PRO 的决策

语言服务提供商 (LSP) 如何协助收集患者自述效果数据
跨国临床试验激增,而且 ePRO 技术的应用呈增长态势,这使得试验申办者经常需要修改最初的 PRO。修改可能包括将 PRO 翻译成其他语言并针对当地文化作出改动(语言验证),或从纸质管理模式迁移到电子管理模式(ePRO 迁移)。在将已修改版本投入到试验中使用前,利用目标患者群体测试这些版本可能有助于发现并解决问题。这可以带来以下多重优势:
- 为患者参与和配合有关 PRO 的临床研究和决策提供机会
- 有助于利用患者意见“微调”PRO 评估,在试验中收集到稳健可靠的 PRO 数据
- 减轻试验参与者的负担
- 用证据满足监管机构所设定的预期,监管机构希望看到 PRO 针对在试验中使用 PRO 的群体进行了相应修改。当使用 PRO 数据佐证产品标签上的疗效时,这一点显得格外重要。
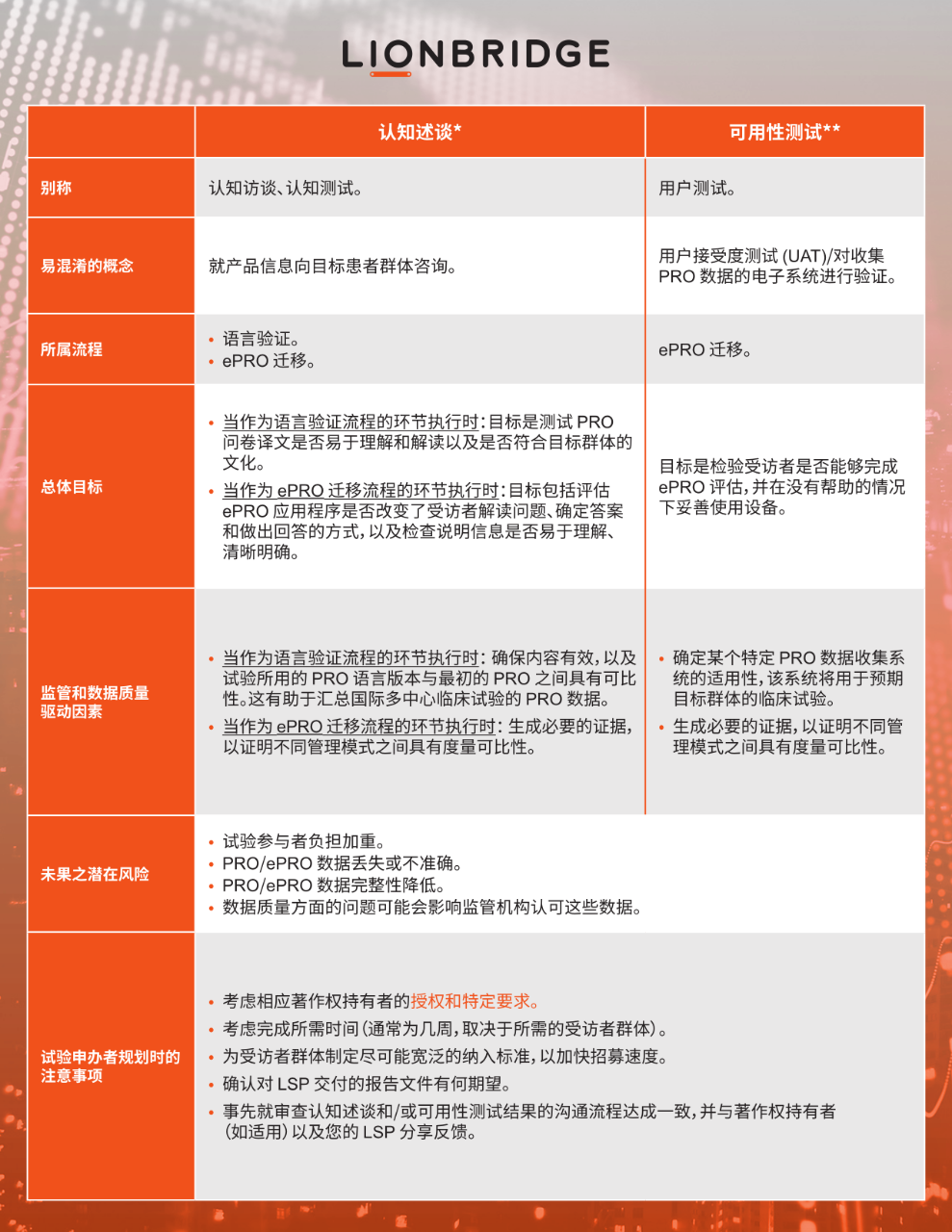
专业 LSP 可以通过认知述谈和可用性测试流程来推进这种测试。测试在相关目标国家/地区进行,测试对象为一小群以目标语言为母语的人士,他们可以充分代表临床试验的目标群体。