언어:
- 서비스 종류
- 생성형 AI
텍스트, 음성, 오디오, 비디오부터 정형/비정형 데이터까지 전 세계 어떤 업체보다 더 많은 콘텐츠를 생성, 변환, 테스트 및 학습합니다.
AI 기반 기술을 활용하여 글로벌 커뮤니케이션을 강화하세요.

- 산업 분야
- LAⁱNGUAGE CLOUD™
Lionbridge Lainguage Cloud를 발판으로 삼아 로컬라이제이션 전체 단계와 콘텐츠 여정을 관리하세요.

- 회사 소개

텍스트, 음성, 오디오, 비디오부터 정형/비정형 데이터까지 전 세계 어떤 업체보다 더 많은 콘텐츠를 생성, 변환, 테스트 및 학습합니다
콘텐츠 서비스
- 기술문서 작성
- 교육 및 이러닝
- 재무 보고서
- 디지털 경험 평가
- 디지털 마케팅
- 콘텐츠 최적화
번역 서비스
- 비디오 로컬라이제이션
- 소프트웨어 로컬라이제이션
- 웹사이트 로컬라이제이션
- 규제 관련 기업을 위한 번역
- 통역
- 라이브 이벤트
테스팅 서비스
- 기능 QA 및 테스팅
- 호환성 테스팅
- 상호 운용성 테스팅
- 성능 테스팅
- 액세스 가능성 테스팅
- UX/CX 테스팅
솔루션
- 번역 서비스 모델
- 기계번역
- Smart Onboarding™
라이온브리지 지식 허브
- 긍정적 환자 결과
- 로컬라이제이션의 미래
- 혁신에서 면역으로
- 코로나19 리소스 센터
- 대혼란 시리즈
- 환자 참여
- 라이온브리지 인사이트
AI 기반 기술을 활용하여 글로벌 커뮤니케이션을 강화하세요.
생성형 AI
생성형 AI 마케팅 솔루션
Lionbridge Lainguage Cloud를 발판으로 삼아 로컬라이제이션 전체 단계와 콘텐츠 여정을 관리하세요.
Lainguage Cloud™ Platform
연결성
번역 커뮤니티
워크플로 기술
Smairt Content™
Smairt MT™
Smairt Data™
언어 선택 :
환자 보고 결과(PRO) 평가는 의료 제품 개발에 환자의 의견을 반영하는 데 효과적인 도구 역할을 해왔습니다. PRO 데이터는 초기 개발 단계부터 임상시험 및 관찰 연구에 이르기까지 의료 제품의 전체 수명주기 동안 수집할 수 있습니다. PRO는 아래와 같은 항목의 근거 자료로 활용될 수 있습니다.
- 선정 기준
- 기준선 평가
- 효능 평가
- 임상시험 또는 승인 후 안전성 연구에서의 안전성 평가
미국 FDA 및 EMA와 같은 규제 기관은 PRO를 '환자 경험 데이터(PED)'라는 더 포괄적인 범주에 포함합니다. PED에는 환자 여정 전반에서 환자가 겪은 경험, 환자의 관점과 요구사항, 우선순위 등이 반영되어 있습니다. 이러한 기관은 전략적 계획 및 지침 문서를 활용해 PED를 제품 개발 및 규제 의사결정에 기여하는 핵심 구성 요소로 홍보했습니다.
규제 의사결정에 있어서의 PED
그러나 PED를 사용하는 사안에 아직 규제기관과 제약업계가 완전한 합의에 도달한 것은 아니며 현재 논의가 오가고 있습니다. FDA는 PED 이용을 강력하게 지지하고 있지만 시판 허가 신청자, 환자, 간병인은 FDA에서 신약 및 바이오의약품 신청서를 검토하고 규제 의사결정을 진행하는 동안 이러한 데이터가 어떻게 사용되는지 명확하게 알지 못한다는 보고가 있었습니다. 마찬가지로, EMA 주도로 열린 다학제 워크숍에서 업계 이해관계자들은 유럽연합 규제기관이 PED를 반기지 않거나 이 데이터를 가치 있게 여기지 않는다고 인식하는 것으로 나타났습니다.
이러한 이유로 업계 이해관계자들은 시판 허가를 신청할 때 PED를 보강 자료로 추가하기를 꺼립니다. 이후 EMA는 시판 허가 신청 자료의 일부로 PED를 '환영하고 원한다'고 입장을 밝혔습니다.
가치 있고 충분하며 신뢰할 수 있는 PED를 생성하려면 규제 의사결정 과정에 이러한 데이터가 사용되는 것과 관련하여 더욱 철저하게 투명성을 확보해야 합니다. 이러한 투명성을 달성하기 위해서는 다지역 임상시험에서 수집된 PED에 대한 규제 요건이 관할권 전체에서 조화를 이루어야 합니다. 유럽제약산업협회(EFPIA)에서 제안한 대로 ICH M4E는 이러한 글로벌 조화 요건에 대한 적합한 수준을 제시합니다.

환자 보고 결과 데이터의 수집 방안 개선
규제 불확실성은 의료 제품 개발 전반에서 반드시 고려해야 하는 문제지만 임상시험 참여자가 시급하다고 여길 사안은 아닙니다. 더 긴급한 문제는 PRO 적용으로 인해 PRO 보고 당사자가 느낄 수 있는 부담입니다. 아래와 같은 다양한 요인이 부담감을 가중시킬 수 있습니다.
- 임상시험의 PRO 설문지 수
- PRO 평가 빈도
- PRO 설문지의 항목 수 및 완료 시간
- 임상시험에 사용된 PRO 설문지 전반에 존재하는 반복 질문 또는 유사 질문
- 불명료한 언어
- 불편한 PRO 데이터 수집 형식 또는 양식
임상시험에서 성공적으로 PRO 데이터를 수집하기 위해서는 보고 당사자의 부담을 예측하고 완화하는 것이 매우 중요합니다. Aiyegbusi와 동료들은 PRO 보고 당사자가 느끼는 부담을 해소하기 위해 방법론적으로 고려해야 할 주요 사항을 간결하게 요약하여 발표했습니다. 여기에는 다음 사항이 포함됩니다.
- 임상시험에 사용할 PRO를 채택하는 명확한 근거
- 질환의 특성 및 임상시험 중재의 효과를 고려한 평가 일정
- 적절한 경우, 기술을 활용해 PRO 완료 지원
- PRO 채택 및 전달에 관한 초기 의사 결정에 환자 참여

언어서비스 제공업체의 PRO 데이터 수집 지원 방법
다국적 임상시험이 급증하고 ePRO 기술의 사용이 늘어나면서 임상시험의뢰자가 PRO 원본을 수정해야 하는 일이 자주 발생합니다. 이러한 수정 작업에는 다른 언어로 번역, 문화 간 적응(언어 유효성 검사), 종이문서에서 전자문서 방식으로 이전(ePRO 마이그레이션) 등이 있습니다. 수정된 버전을 대상 환자 모집단에 테스트해 보면 해당 버전을 임상시험에 적용하기 전에 문제를 파악하고 해결할 수 있습니다. 이에 따른 이점은 매우 많습니다.
- 임상연구 및 PRO 관련 의사결정에 환자가 참여할 기회 제공
- 환자의 의견을 반영하여 PRO 평가를 '세부 조정'함으로써 임상시험에서 견고하고 신뢰할 수 있는 PRO 데이터를 수집하는 데 기여
- 임상시험 참여자의 부담 해소
- 임상시험에서 모집단이 사용하게 될 PRO의 수정 절차와 관련하여 규제기관이 설정한 증거 기대치 충족. 이는 PRO 데이터가 제품 표기사항 요건을 뒷받침하는 데 사용되는 경우에 특히 중요
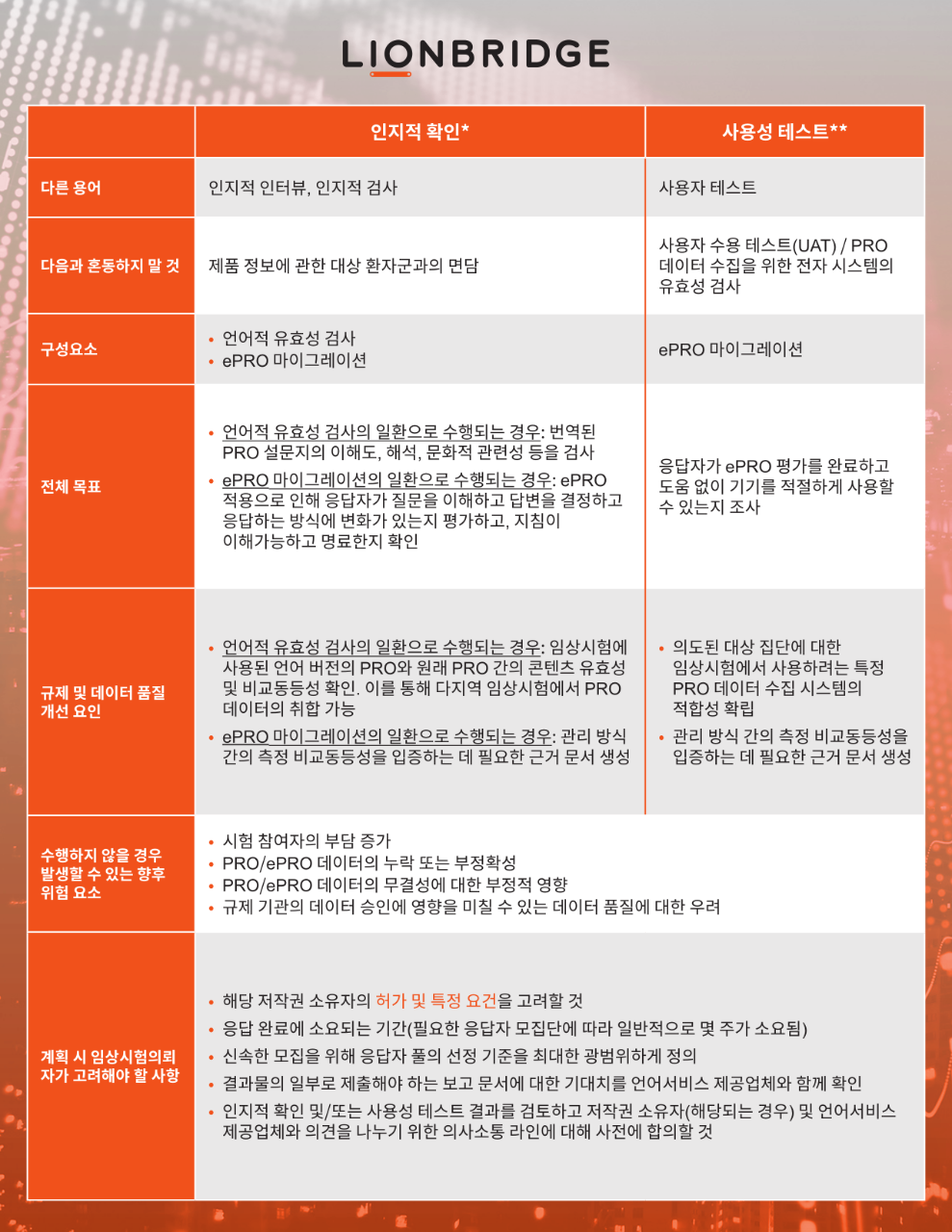
전문 언어서비스 제공업체(LSP)는 이러한 테스트를 진행하기 위해 인지적 확인 서비스 및 사용성 테스트 절차를 활용합니다. 테스트는 관련 대상 국가에서 임상시험의 대상 모집단을 적절히 대표하는 소규모 원어민 그룹의 대상 언어로 진행됩니다.
'임상시험 결과 평가를 임상시험에 활용하는 데 필요한 저작권 사용 허가' 블로그 게시글
* 번역 및 문화 간 적응을 위한 ISPOR 태스크포스(ISPOR Task Force for Translation and Cultural Adaptation) 및 환자 보고 결과(PRO) 컨소시엄(Patient-Reported Outcome (PRO) Consortium) 참조
** ISPOR ePRO 우수 연구사례 태스크포스(ISPOR ePRO Good Research Practices Task Force) 및 PROM 관리 모드 간 ISPOR 측정 비교동등성 태스크포스(ISPOR Measurement Comparability Between Modes of Administration of PROMs Task Force) 참조
문의하기
임상시험에서 환자 보고 결과 데이터를 수집하기 위해 언어 지원이 필요하신가요? 전문 생명과학 번역 서비스를 제공하는 라이온브리지(Lionbridge)는 임상 결과 평가 분야에도 폭넓은 지식을 보유하고 있습니다. 지금 바로 문의하여 생명과학 언어서비스 제공업체로서 라이온브리지가 제공하는 솔루션에 대해 자세히 알아보세요.

