语言:
- 我们的服务范围
- 生成式人工智能 (GenAI)
我们致力于创建、转换、测试和训练从文本、语音、音频、视频到结构化和非结构化数据的广泛内容,所处理的内容数量远超全球其他任何公司。
利用由 AI 支持的技术助推全球沟通。

- 行业
- LAⁱNGUAGE CLOUD™
利用 Lionbridge Lainguage Cloud 支持您的端到端本地化和内容生命周期

- 公司简介

我们致力于创建、转换、测试和训练从文本、语音、音频、视频到结构化和非结构化数据的广泛内容,所处理的内容数量远超全球其他任何公司。
内容服务
- 技术文献写作
- 培训和在线学习
- 财务报告
- 数字体验评估
- 数字营销
- 内容优化
翻译服务
- 视频本地化
- 软件本地化
- 受监管内容翻译与本地化
- 口译
- 现场活动
- 网站本地化
测试服务
- 功能 QA 和测试
- 兼容性测试
- 互操作性测试
- 性能测试
- 辅助功能测试
- UX/CX 测试
解决方案
- 翻译服务模式
- 机器翻译
- Smart Onboarding™
Lionbridge 知识中心
- 改善患者治疗结果
- 本地化的未来
- 将创新想法转化为免疫实践
- 新冠肺炎疫情资源中心
- 颠覆系列
- 患者配合度
- Lionbridge 见解
利用由 AI 支持的技术助推全球沟通。
生成式人工智能 (GenAI)
GenAI 市场营销解决方案
利用 Lionbridge Lainguage Cloud 支持您的端到端本地化和内容生命周期
Lainguage Cloud™ Platform
轻松连接
翻译团队
工作流程技术
Smairt Content™
Smairt MT™
Smairt Data™
选择语言:
产品信息
来源:欧洲药品管理局
没有语言文字的帮助,就无法正确使用处方药
语言是药品标签必不可少的要素。这是因为标签翻译不当可能会导致严重后果,并且欧盟市场使用的官方语言超过 24 种。标签错误不仅会对患者健康,还会对负责标签准确性和一致性的药品制造商构成风险。如果欧盟成员国审阅人员在语言审查流程期间确定翻译质量不佳,这可能会耽误欧盟委员会征求意见,而这是药品获批并进入欧盟市场之前的最后一步。
美国国立医学图书馆引用的一项研究显示,有多达 33% 的医疗差错归咎于包装和标签混乱。该研究并未披露这种混乱在多大程度上由源语言标签导致或由其他语言的翻译版本导致。
但我们明确知道的是,语言本身是主观的,它涉及许多文化习俗和文字规范。人们阅读时会根据语境和自身的语言水平去理解其含义,因此很容易误解。语言审查流程是一个重要的质量控制步骤,对于标签监管和最终在欧盟的多语言环境中正确使用药物必不可少。
集中审评程序使药品能够进入整个欧盟市场
按照 726/2004 号法规的规定,集中审评程序 (CP) 是许多新药产品在欧盟获得批准的强制性监管途径。其中包括含新活性成分且具有重要治疗适应症(例如,癌症、糖尿病、自身免疫疾病和病毒性疾病)的药物以及通过生物技术工艺和单克隆抗体方式开发的药物。
这些药物因其满足了关键患者需求、填补患者需求空白,或包含科学创新而“强制性”必须要通过 CP 审批,除此之外,许多药品研发主办者也将通过此方式寻求批准。这使得他们能够从互认监管标准中受益,并通过一次药物申请获准进入整个欧盟市场。欧盟成员国之间的监管统一让患者能够获得治疗干预措施,并加快主办者药品的上市速度。

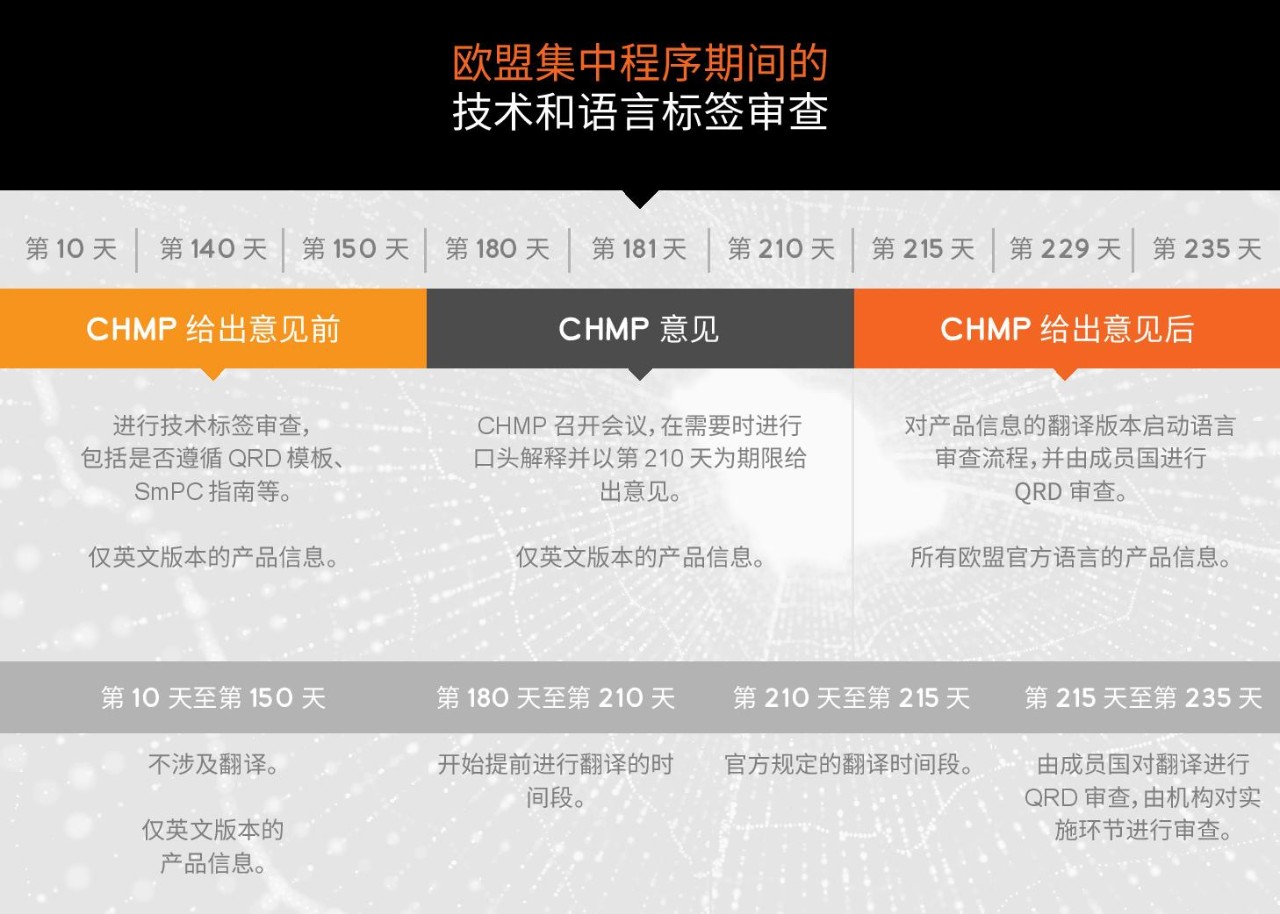
语言审查程序监管要求
语言审查程序是欧洲独有的。它要求语言服务提供商掌握欧盟标签语言合规要求的专业知识,并具备应对监管类文档质量审查局 (QRD) 的经验。新药申请和药物时限延长都需经过相同的语言审查程序。然而,批准后的药物变更将根据变更类型进行语言审查。语言审查程序还包括重新评估、更新、推荐和安全程序。
语言审查由各个欧盟成员国指定的国家 QRD 成员来执行。他们按照下文所列的标准审查翻译质量。
QRD 译文审查
- 单词或句子漏译
- 科学内容(例如术语)翻译错误
- 不准确(错误的翻译 — 包括拼写、标点符号、语法错误)
- 编缉性、风格性修改(比如,改变措辞)
- 格式
QRD 审阅人员必须驳回翻译并将其退还申请人,并解释译文不合格的理由。虽然很少见,但解释本身就证明了语言在本质上是主观的,即使是 QRD 审阅人员可能也难以摆脱自身的语言偏好。
如果监管类文件审阅人员对翻译质量有疑虑,而主办者的语言服务提供商具备与此类审阅人员交流的语言专业知识,那么主办者将会从中受益。

时机与合作伙伴关系至关重要
语言审查程序有着严格的规定时限。对于翻译,官方规定的窗口期为 5 天,时间非常紧张。这是因为获得欧盟批准需要涉及许多语言,并且需要投入精力招募和协调 24 种语言的合格翻译人员。因此翻译工作应该在官方意见公布之前开始,最好是尽可能接近第 180 天并在主要的未决问题得以解决之后进行。
对于标签翻译的时效和成效,技术的重要性往往被过于夸大,甚至被说成是唯一的金钥匙。我们认为,在语言审查程序期间,技术无法取代强大合作伙伴关系的价值,在审查过程中,卓越的服务在很大程度上依赖于主办者和供应商众多不同的人力资源和审阅人员。
Lionbridge 确保全球市场都能理解药品的最终产品标签内容,包括处方信息、面向医护专业人员和监管机构的产品特性摘要 (SPC)、包装标签和说明书等。我们会对您的标签内容进行验证,以确保其准确、完整,并符合所有目标市场和语言的法规要求。
作为监管类文件翻译领域的专家,我们可以翻译并验证临床试验研究方案终点所用试验药物、安慰剂、对照药物或辅助药物的一级、二级和/或三级药品标签,帮助您在全球市场上达到良好生产规范 (GMP) 对药品标签的准确性和合规性标准。
联系我们
如果您想了解 Lionbridge 生命科学服务团队如何鼎力支持您的合规标签翻译与本地化需求,请立即联系我们。