IDIOMA:
- QUÉ HACEMOS
- IA GENERATIVA
Creamos, transformamos, probamos y enseñamos más contenido que nadie en el mundo, desde texto, voz, audio, vídeo, hasta datos estructurados y sin estructurar.
Centros de conocimientos de Lionbridge
- Resultados positivos del paciente
- El futuro de la localización
- La innovación al servicio de la inmunidad
Aproveche la tecnología mejorada con IA para impulsar sus comunicaciones globales.

- SECTORES
- LAⁱNGUAGE CLOUD™
Nuestros expertos conocen los pormenores del sector y sus dificultades.
Utilice las prestaciones y ventajas de Lionbridge Lainguage Cloud para el ciclo del contenido y la localización

- QUIÉNES SOMOS

Creamos, transformamos, probamos y enseñamos más contenido que nadie en el mundo, desde texto, voz, audio, vídeo, hasta datos estructurados y sin estructurar.
Servicios de contenido
- Redacción técnica
- Formación y aprendizaje electrónico
- Informes financieros
- Evaluaciones de la experiencia digital
- Marketing digital
- Optimización de contenido
Servicios de traducción
- Localización de vídeo
- Localización de software
- Localización de sitios web
- Traducción para empresas reguladas
- Interpretación
- Eventos en directo
Servicios de pruebas
- Pruebas y controles de calidad funcionales
- Pruebas de compatibilidad
- Pruebas de interoperabilidad
- Pruebas de rendimiento
- Pruebas de accesibilidad
- Prueba UX/CX
Soluciones
- Modelos de servicio de traducción
- Traducción automática
- Smart Onboarding™
Nuestros Centros de conocimientos
- Resultados positivos del paciente
- El futuro de la localización
- La innovación al servicio de la inmunidad
- Centro de recursos lingüísticos para la COVID-19
- Serie Tiempos de cambio
- Compromiso del paciente
- Monográficos de Lionbridge
Aproveche la tecnología mejorada con IA para impulsar sus comunicaciones globales.
IA generativa
Soluciones de marketing basadas en IA generativa
Nuestros expertos conocen los pormenores del sector y sus dificultades.
Sector biomédico
- Sector farmacéutico
- Aspectos clínicos
- Cuestiones normativas
- Actividades posteriores a la aprobación
- Ámbito corporativo
- Productos sanitarios
- Validación e investigaciones clínicas
- Cuestiones normativas
- Actividades posteriores a la autorización
- Ámbito corporativo
Banca y finanzas
Minorista
Lujo
Comercio electrónico
Lionbridge Games
Automoción
Bienes de consumo envasados
Tecnología
Fabricación industrial
Servicios jurídicos
Viajes / Hostelería
Utilice las prestaciones y ventajas de Lionbridge Lainguage Cloud para el ciclo del contenido y la localización
Lainguage Cloud™ Plataforma
Conectividad
Comunidad de traducción
Software TMS
Smairt Content™
Smairt MT™
Smairt Data™
Nuestra gente es nuestro orgullo. Más de 20 años ayudando a las empresas a conectar con sus clientes.
Acerca de nosotros
Datos importantes
Liderazgo
Centro de confianza
SELECCIONAR IDIOMA:
En nuestra última serie de artículos sobre la COVID-19, los expertos de Lionbridge ofrecen su visión sobre el ecosistema del desarrollo clínico y de las aprobaciones de los organismos reguladores durante la pandemia y de cara al futuro.
Gracias a nuestro alcance, a nuestra excelencia en el ámbito de los servicios y a nuestro paquete de soluciones lingüísticas, tecnológicas y de comunicación, Lionbridge está bien situada para apoyar cualquier aceleración de las actividades encaminadas a la comercialización de vacunas y tratamientos que salven vidas.
Los datos estadísticos incluidos en este artículo son los últimos actualizados el lunes, 7 de diciembre de 2020.
La carrera por la vacuna de la COVID-19
Si no quiere quedarse atrás en la búsqueda de una vacuna contra el virus de la COVID-19, lo mejor es que se prepare bien para esta carrera. El desarrollo de candidatas a vacuna avanza a una velocidad nunca vista, hasta tal punto que el procedimiento tradicional para desarrollar nuevos tratamientos parece un paseo por el parque. En esta competición, el número cada vez mayor de víctimas humanas nos está pisando los talones y es urgente que todas las partes implicadas en la infraestructura sanitaria mundial aprieten el paso. Ya son más de 1,5 millones de muertes y 66 millones de casos confirmados lo que suma esta pandemia y el número va incrementándose en todo el mundo, según la OMS (Organización Mundial de la Salud).
En esta etapa de la carrera, se están llevando a cabo 1157 ensayos en laboratorios clínicos de todo el mundo dedicados a buscar una cura para la infección del SARS-CoV y hay al menos 100 vacunas en proceso de desarrollo. El 20 de noviembre, Pfizer y BioNTech anunciaron que iban a solicitar una autorización de uso de emergencia a la Administración de Alimentos y Medicamentos estadounidense (FDA, por sus siglas en inglés) para su candidata a vacuna BNT162b2. Días después, el 25 de noviembre, Moderna anunció que la Comisión Europea había aprobado un acuerdo previo de compra de 80 millones de dosis de su vacuna mRNA-1273.
Entre las otras candidatas en las últimas etapas del proceso, están la vacuna de AstraZeneca, conocida como AZD1222, que se desarrolló en colaboración con la Universidad de Oxford, y la vacuna recombinante Ad5-nCoV, desarrollada por CanSino Biologics con sede en China.

Agilizar los plazos sin sacrificar la calidad
Normalmente, la sensación de urgencia y los cambios drásticos son los mecanismos de respuesta más efectivos a la hora de combatir una nueva amenaza y esta pandemia es clara muestra de ello. La búsqueda de la excelencia operativa y la realización de ensayos virtuales han sido decisivos en el desarrollo de nuevas vacunas contra la COVID-19. Por otra parte, la urgencia y gravedad de esta pandemia no permiten concesiones en cuestión de calidad.
Los organismos reguladores de todo el mundo están ofreciendo vías más rápidas para el asesoramiento científico y las autorizaciones de uso de emergencia. Al mismo tiempo, estas entidades han hecho hincapié en que los datos de investigación deben ser los apropiados tanto cualitativa como cuantitativamente para que las vacunas reciban luz verde desde el punto de vista normativo.
La guía orientativa de la FDA de octubre sobre la autorización de uso de emergencia de vacunas para prevenir la COVID-19 aborda de lleno la problemática de la calidad. Solo se expide una EUA si el organismo supervisor determina que «los beneficios de la vacuna compensan los riesgos en función de los datos recabados en al menos un ensayo de fase III bien diseñado que pruebe que la vacuna es eficaz y segura de una forma clara y convincente».
Equilibrio constante entre seguridad, eficacia y calidad
En el actual proceso clínico de desarrollo de vacunas contra la COVID-19, observamos ensayos de fase III de alcance considerable con hasta 40 000 participantes de cientos de localizaciones y que avanzan con notable rapidez. Los ensayos de fase II/III de Pfizer para evaluar la seguridad y efectividad de su candidata a vacuna (BNT162b2) dieron comienzo solo tres meses después del inicio de sus ensayos de fase I/II destinados a comprobar la inocuidad e inmunogenicidad de la vacuna. Y solo dos horas después de recibir el visto bueno de la FDA, Pfizer administró la primera dosis de su vacuna al primer participante del ensayo.
En Rusia, a 23 de noviembre, se han aprobado dos vacunas. Pero hay que tener en cuenta que fueron aprobadas por el ministerio de Sanidad de Rusia antes de llegar a la fase III. El comunicado que emitió Vladimir Putin en agosto suscitó una gran preocupación entre los investigadores de vacunas que tacharon de «completamente absurda» y «muy alarmante y peligrosa» la decisión de autorizarla y registrarla antes de tiempo.
El desarrollo de medicamentos siempre busca la estabilidad entre seguridad, efectividad y calidad y la carrera por la vacuna debe ir de la mano de la integridad y fiabilidad de los datos.
De la competencia a la colaboración: una carrera contra el tiempo
Durante la pandemia, las principales empresas del sector que suelen competir para comercializar antes nuevos tratamientos innovadores han demostrado un afán colaborador nunca visto. Las tecnologías patentadas y la experiencia (que normalmente son objeto de una estricta vigilancia dentro del sector empresarial farmacéutico) se comparten ahora para acelerar la creación de la vacuna de la COVID-19.
Una de estas coaliciones nace de la colaboración entre GSK y Sanofi, dos de los mayores fabricantes de vacunas del mundo y rivales desde hace mucho tiempo. GSK ha dado acceso a Sanofi a su tecnología de adyuvantes que, en combinación con la vacuna candidata de Sanofi, puede mejorar la respuesta inmune y reducir la cantidad necesaria de vacuna por dosis. Este avance será determinante a la vista del nivel de propagación de la pandemia en Estados Unidos y del compromiso de los dos socios con el gobierno norteamericano para suministrar 100 millones de dosis.
Colaboración: implementación simultánea de las fases
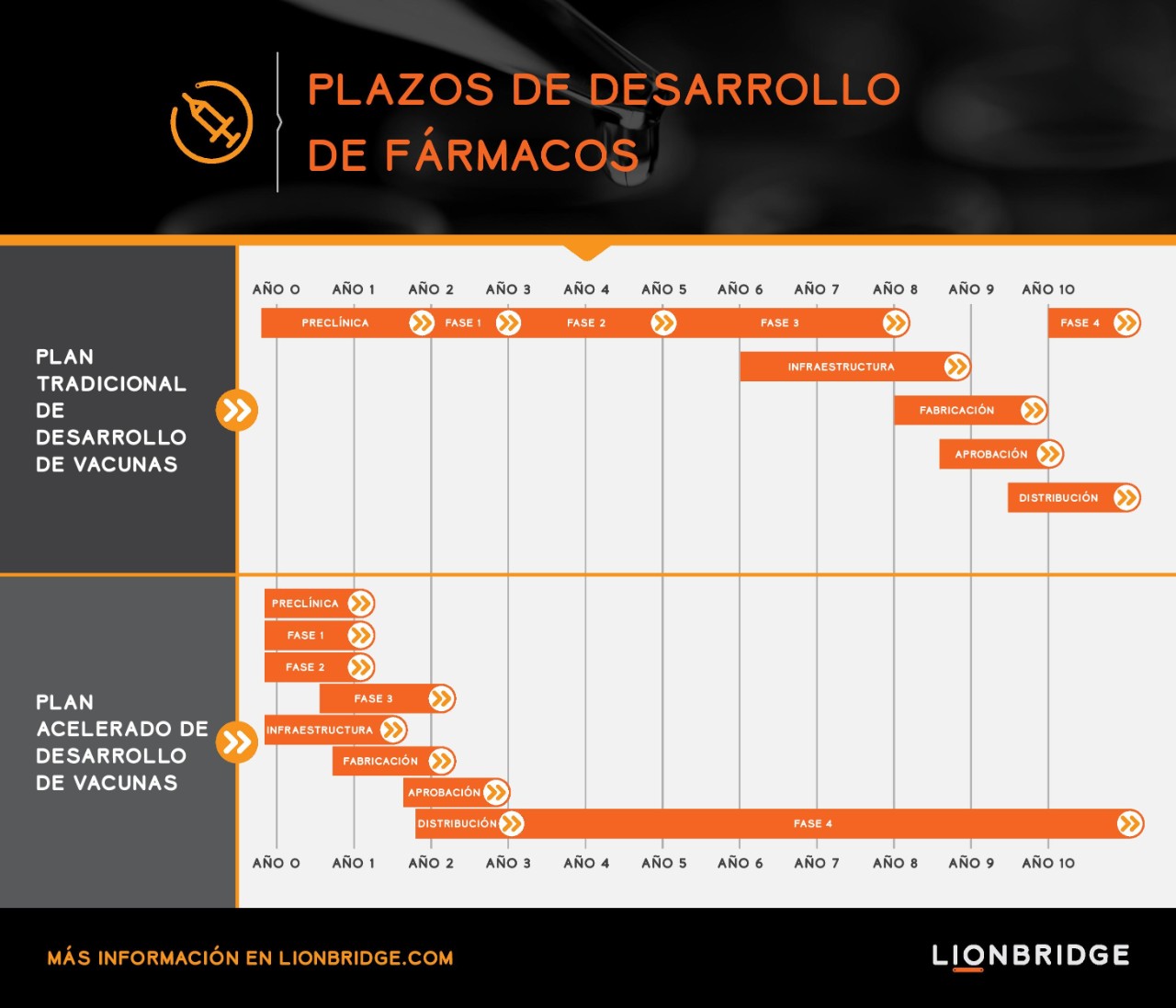
Este ritmo acelerado en el desarrollo no tiene precedentes.
El proceso de elaboración de una vacuna suele tardar más de una década, desde su descubrimiento hasta la obtención de la licencia oficial, pasando por el programa de desarrollo clínico en fases secuenciales. El proceso de desarrollo acelerado que observamos actualmente para las vacunas contra la COVID-19 se realiza según un modo de ejecución simultáneo. Se están implementando modelos de ensayos que combinan las fases I/II y las fases II/III para acelerar el proceso de desarrollo. Los ensayos incluyen varias evaluaciones de resultados, diferentes grupos de población y otras candidatas a vacunas.
Por ejemplo, Pfizer sometió a pruebas a cuatro candidatas de forma paralela en su ensayo de fase I/II antes de quedarse con su candidata principal para la fase II/III (BNT162b2). El ensayo de fase II/III para la BNT162b2 contó con unos 44 000 participantes en 155 localizaciones de pruebas en Estados Unidos, Argentina, Brasil, Alemania, Sudáfrica y Turquía. La magnitud y el alcance de este ensayo no solo son considerables en términos de número de participantes y localizaciones, sino también por la diversidad de los participantes. El ensayo empezó con adultos pertenecientes a tres grupos de edad de hasta 85 años y después amplió su alcance al incluir a adolescentes de hasta 12 años. Además, la vacuna se probó en pacientes con VIH y hepatitis B o C crónicas. Pfizer y BioNTech, codesarrolladores de la vacuna, esperan producir hasta 50 millones de dosis en 2020 y 1300 millones de dosis para finales de 2021.
Impacto de la COVID-19 en los futuros modelos de servicio
La pandemia de la COVID-19 ha demostrado que es posible reducir a solo dos años el plazo de desarrollo estándar de ocho años entre la fase preclínica y el final de la fase III, y conseguir que una vacuna llegue al mercado en solo tres años. Este ritmo de desarrollo es completamente insólito. Por eso esperamos que las vacunas estén disponibles a finales de este año.

¿Este esfuerzo internacional sin precedentes del sector, los organismos reguladores, los gobiernos y las organizaciones sanitarias supondrá el acicate para agilizar el desarrollo de otras terapias esenciales o para enfermedades raras que aún no tienen tratamiento? ¿Por qué los pacientes con estas afecciones no se pueden beneficiar de la excelencia operativa que hemos constatado en el marco de esta pandemia? La pandemia no solo ha demostrado que los tiempos de desarrollo y producción pueden recortarse en varios años, sino que también ha incentivado el uso de infraestructuras y herramientas digitales como diarios electrónicos, servicios de telemedicina, teléfonos inteligentes y dispositivos portátiles que han contribuido a acelerar la ejecución de los ensayos.
Esta ejecución acelerada afectará a toda la cadena de distribución y a los proveedores de servicios, que tendrán que actuar antes y con más rapidez para satisfacer las demandas del sector y las de los organismos reguladores. En lo que respecta a los proveedores de servicios lingüísticos, el intenso ritmo de los estudios clínicos y las autorizaciones de comercialización tendrá un gran impacto en el modelo de prestación de servicios y exigirá un rendimiento excepcional en las entregas, la asignación de recursos y la capacidad lingüística. El uso de activos lingüísticos, la automatización y la adaptabilidad se convertirán en los ejes centrales para crear una oferta de servicios ágil, acompañada de un sistema riguroso de control de la calidad lingüística para la gestión de riesgos.