LANGUE :
- CE QUE NOUS FAISONS
- IA
Pôles de connaissances Lionbridge
- Résultats positifs pour les patients

- SECTEURS

Services de contenu
- Rédaction technique
- Formation et eLearning
- Reporting financier
- Marketing numérique
- Optimisation de contenu
Services de traduction
- Localisation vidéo
- Localisation de logiciels
- Localisation de site Web
- Traduction certifiée
- Interprétation
- Événements en direct
Services de tests
- Assurance qualité fonctionnelle et tests
- Tests de compatibilité
- Tests d'interopérabilité
- Test des performances
- Tests d'accessibilité
- Test utilisateur/client
Solutions
- Modèles de services de traduction
- Traduction automatique
- Smart Onboarding™
Nos pôles de connaissances
- Résultats positifs pour les patients
- Futur de la localisation
- De l'innovation à l'immunité
- Centre de ressources pour la COVID-19
- Série Disruptive
- Engagement patient
- Lionbridge Insights
Sciences de la vie
- Pharmaceutique
- Clinique
- Réglementaire
- Post-approbation
- Entreprise
- Dispositifs médicaux
- Validation et clinique
- Réglementaire
- Post-autorisation
- Entreprise
Banque et finance
Vente au détail
Luxe
E-commerce
Lionbridge Games
Automobile
Biens de Consommation
Technologie
Fabrication industrielle
Services juridiques
Tourisme
SÉLECTIONNER LA LANGUE :
Les évaluations des résultats rapportés par les patients (RRP) sont devenues des outils importants pour intégrer l'avis des patients dans le développement de produits médicaux. Les données sur les RRP peuvent être collectées tout au long du cycle de vie du produit, du début du développement aux essais cliniques et aux études d'observation. Les RRP peuvent servir de base pour :
- Les critères d'inclusion
- L'évaluation de la base de référence
- L'évaluation de l'efficacité
- L'évaluation de la sécurité dans les essais cliniques et/ou les études sur la sécurité post-autorisation
Les organismes de réglementation, comme la FDA et l'EMA aux États-Unis, classent les RRP parmi la vaste catégorie des « données sur l'expérience des patients (DEP) ». Les DEP reflètent les expériences des patients, leurs points de vue, leurs besoins et leurs priorités tout au long de leur parcours. Ces organismes se sont appuyés sur leurs initiatives stratégiques et leurs documents d'orientation pour promouvoir les DEP en tant que composant essentiel dans le développement de produits et la prise de décisions réglementaires.
DEP dans la prise de décisions réglementaires
Cependant, l'alignement complet concernant l'utilisation des DEP entre les organismes de réglementation et le secteur est un travail de longue haleine. Bien que la FDA soutienne fortement les DEP, il a été signalé que les auteurs de demandes d'autorisation de mise sur le marché, les patients et les soignants ne bénéficient pas d'une clarté suffisante sur la façon dont l'organisme utilise ces données dans ses décisions liées aux demandes de nouveaux médicaments et produits biologiques. De même, un atelier multidisciplinaire mené par l'EMA a révélé que, selon les parties prenantes du secteur, l'organisme de réglementation de l'UE n'accueille pas volontiers les DEP ou ne les considère pas comme utiles.
En raison de ces facteurs, les parties prenantes du secteur sont réticentes à inclure les DEP dans le cadre des demandes d'autorisation de mise sur le marché. Depuis, l'EMA a clarifié qu'elle « accueille volontiers et souhaite intégrer » les DEP dans les demandes d'autorisation de mise sur le marché.
Pour favoriser la génération de DEP pertinentes, suffisantes et fiables, il faut augmenter la transparence autour de l'utilisation de ces données dans la prise de décisions réglementaires. Cette transparence requiert une meilleure harmonisation des exigences réglementaires, d'une juridiction à l'autre, concernant les DEP collectées dans les essais multirégionaux. Comme l'a proposé la Fédération européenne des associations et industries pharmaceutiques (EFPIA), l'ICH M4E présente le niveau approprié pour un alignement mondial autour de ces exigences.

Meilleures tactiques pour la collecte de résultats rapportés par les patients
Bien qu'il soit essentiel de les traiter dans le développement global des produits médicaux, les incertitudes réglementaires ne constitueront sans doute pas un problème immédiat pour les participants à l'essai. La charge des répondants est un problème plus urgent, auquel l'application de RRP peut donner lieu. Ces différents facteurs peuvent participer au problème :
- Le nombre de questionnaires de RRP dans un essai
- La fréquence des évaluations de RRP
- Le nombre d'éléments dans un questionnaire de RRP/le temps de réponse nécessaire
- Les questions répétitives ou similaires dans les questionnaires de RRP utilisés dans l'essai
- Les formulations peu claires
- Un format ou un mode de collecte de données de RRP peu pratique
Il est essentiel d'anticiper et de limiter la charge pour les répondants, afin d'assurer la réussite globale d'une stratégie de collecte de données de RRP dans un essai. Le Dr Aiyegbusi et ses collègues ont présenté un résumé succinct des principales considérations méthodologiques permettant de diminuer la charge pour les répondants. On y retrouve notamment :
- Une logique claire pour la sélection de RRP à utiliser dans l'essai
- La planification des évaluations en tenant compte de la nature de la maladie et des effets des interventions liées à l'essai
- Un soutien dans le renseignement des RRP via la technologie, le cas échéant
- Une implication et un engagement précoces des patients dans les décisions concernant la sélection et la livraison des RRP

Comment les prestataires de services linguistiques aident à améliorer la collecte des résultats rapportés par les patients
Les promoteurs d'essais doivent souvent modifier les RRP originaux, en raison de la prolifération des essais cliniques multinationaux et de l'augmentation de l'utilisation de la technologie ePRO. Ces modifications peuvent inclure la traduction et une adaptation interculturelle dans d'autres langues (validation linguistique) ou la migration des formulaires papier vers un mode d'administration électronique (migration ePRO). Les tests de versions modifiées auprès de populations de patients cibles peuvent aident à identifier et à résoudre les problèmes avant que ces versions ne soient utilisées dans un essai. Les avantages sont nombreux :
- Donner la possibilité d'impliquer et d'engager les patients dans la recherche clinique et dans les décisions concernant les RRP
- Participer à la collecte de RRP solides et fiables dans l'essai, en « affinant » les évaluations des RRP grâce aux retours des patients
- Réduire la charge pour les participants aux essais
- Respecter les attentes probatoires définies par les organismes de réglementations concernant le processus de modification des RRP pour les populations qui les utiliseront dans l'essai. Cela s'applique tout particulièrement dans les cas où les données des RRP seront utilisées pour étayer les réclamations sur l'étiquetage du produit.
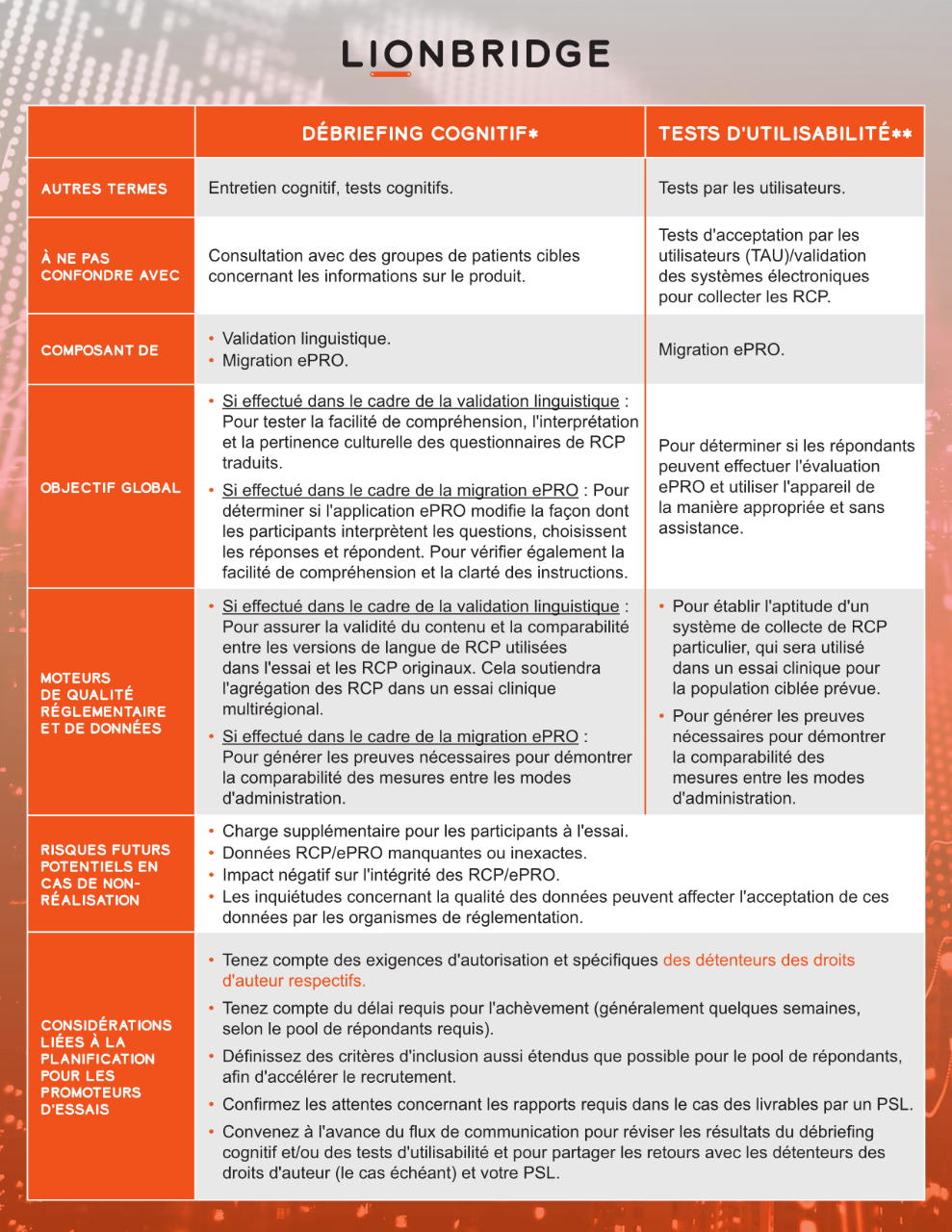
Des prestataires de services linguistiques (PSL) spécialisés peuvent faciliter ces tests, grâce à un débriefing cognitif et à des procédures de tests d'utilisabilité. Les tests sont menés dans le ou les pays cibles concernés avec un petit groupe de locuteurs natifs de la ou des langues cibles, qui représentent correctement la population cible de l'essai clinique.
Contactez-nous
Vous avez besoin d'aide pour la collecte de résultats rapportés par les patients dans les essais cliniques ? Lionbridge bénéficie d'une connaissance approfondie du domaine de l'évaluation des résultats cliniques et d'une expérience dans les services de traduction des sciences de la vie. Contactez-nous dès aujourd'hui pour en savoir plus sur les services de Lionbridge en tant que prestataire de services linguistiques en sciences de la vie.