IDIOMA:
- QUÉ HACEMOS
- IA
Centros de conocimientos de Lionbridge
- Resultados positivos del paciente
- El futuro de la localización
- La innovación al servicio de la inmunidad

- SECTORES

Servicios de contenido
- Redacción técnica
- Formación y aprendizaje electrónico
- Informes financieros
- Marketing digital
- SEO y optimización de contenido
Servicios de traducción
- Localización de vídeo
- Localización de software
- Localización de sitios web
- Traducción para empresas reguladas
- Interpretación
- Eventos en directo
Servicios de pruebas
- Pruebas y controles de calidad funcionales
- Pruebas de compatibilidad
- Pruebas de interoperabilidad
- Pruebas de rendimiento
- Pruebas de accesibilidad
- Prueba UX/CX
Soluciones
- Modelos de servicio de traducción
- Traducción automática
- Smart Onboarding™
Nuestros Centros de conocimientos
- Resultados positivos del paciente
- El futuro de la localización
- La innovación al servicio de la inmunidad
- Centro de recursos lingüísticos para la COVID-19
- Serie Tiempos de cambio
- Compromiso del paciente
- Monográficos de Lionbridge
Sector biomédico
- Sector farmacéutico
- Aspectos clínicos
- Cuestiones normativas
- Actividades posteriores a la aprobación
- Ámbito corporativo
- Productos sanitarios
- Validación e investigaciones clínicas
- Cuestiones normativas
- Actividades posteriores a la autorización
- Ámbito corporativo
Banca y finanzas
Minorista
Lujo
Comercio electrónico
Lionbridge Games
Automoción
Bienes de consumo envasados
Tecnología
Fabricación industrial
Servicios jurídicos
Viajes / Hostelería
SELECCIONAR IDIOMA:
En 2014 se publicó el Reglamento de la UE sobre ensayos clínicos (CTR) y esto cambió de raíz el panorama normativo aplicable a ensayos clínicos en toda Europa. 2024 marca el final del plazo de transición de tres años desde la Directiva sobre ensayos clínicos (CTD), que se derogó el 31 de enero de 2022. El 31 de enero de 2025 entrará plenamente en vigor el CTR. Los ensayos que estén en curso y cuya última visita al paciente sea posterior al 30 de enero de 2025 deben cambiar de EudraCT al sistema de información sobre ensayos clínicos (CTIS). Una vez finalizada la transición, los promotores de ensayos descubrirán que con el CTR es esencial contar con una estrategia lingüística para sus ensayos, ya que estos implican un mayor volumen de contenido. Siga leyendo para conocer los posibles desafíos que plantea el CTR en materia lingüística y cómo puede ayudarle la IA a superarlos.
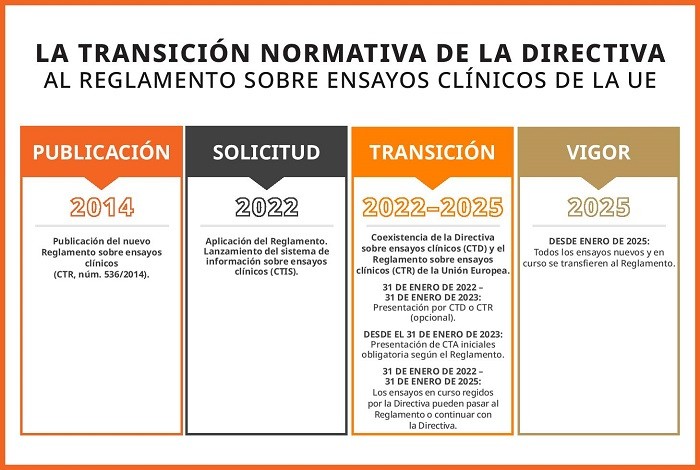
La excelencia tras los tiempos de cambio
El CTR se ha implementado para impulsar la investigación clínica multinacional en la UE. A pesar de las dificultades y las interrupciones del periodo de transición, se ha conseguido implantar los cambios con el objetivo de armonizar los requisitos y optimizar la ejecución de los ensayos clínicos en todo el territorio de la Unión. Con la implementación de un sistema de información sobre los ensayos clínicos (CTIS, por sus siglas en inglés), el procedimiento de solicitud de los ensayos clínicos será más eficiente en toda la UE. Además, existirá la posibilidad de realizar solicitudes individuales y evaluaciones conjuntas en todos los Estados miembros involucrados. El nuevo procedimiento reduce los 60 días a 45 (sin contar los periodos de ampliación para la solicitud de información).
Además, la transición legal de una Directiva a un Reglamento en la UE permite la armonización de requisitos técnicos en los diferentes Estados miembros. Esto debería hacer más eficientes la ejecución y las aprobación de los ensayos, lo que conlleva ventajas para promotores, pacientes y legisladores. La interfaz pública del CTIS también aumentará la transparencia de la investigación clínica regional y dará a los pacientes y posibles participantes en los ensayos acceso a información sobre ensayos clínicos regionales.
La finalidad del CTR, según la definición de la Agencia Europea del Medicamento, es la siguiente:
«…promover la innovación y la investigación en la UE, facilitando la realización de grandes ensayos clínicos en varios Estados miembros de la UE/países del EEE».
Las ventajas del CTIS, según la definición de la Agencia Europea del Medicamento, son las siguientes:
- «Permite a los promotores solicitar la autorización de los ensayos clínicos hasta en 30 países europeos con una única solicitud en línea;
- permite a los legisladores nacionales tramitar de forma colaborativa las solicitudes de ensayos clínicos en más de un país, solicitar información adicional, autorizar o denegar un ensayo y supervisar los ensayos autorizados;
- facilita la extensión de ensayos a otros países del EEE;
- posibilita la transparencia y el acceso a información de cualquier parte interesada en ensayos clínicos realizados en el EEE a través de un sitio web público con capacidad de búsqueda».
Una media de seis Estados miembros en ensayos multinacionales
Desde el lanzamiento del CTIS en 2022, se han presentado 3657 solicitudes de ensayos clínicos (CTA). Tan solo en el mes de enero de 2024, se presentaron 309 solicitudes. De estas, 170 eran CTA iniciales, y los ensayos clínicos comerciales supusieron el mayor porcentaje de los ensayos multinacionales. En enero de 2024, en el CTIS había 1144 ensayos multinacionales con una decisión tomada; de media, en estos ensayos había seis Estados miembros. Para todos estos ensayos, es necesario traducir dosieres de documentación a los idiomas oficiales locales de los Estados miembros de la UE. En el gráfico siguiente se representa la distribución de las CTA iniciales para ensayos multinacionales presentadas desde enero de 2022.

Soluciones de IA: el mayor volumen y velocidad exigidos requieren estrategias lingüísticas con IA
Si el CTR consigue atraer ensayos clínicos de mayor envergadura a la Unión Europea, las tareas lingüísticas serán un aspecto cada vez más importante en los presupuestos de los ensayos clínicos y para el personal encargado de gestionar las solicitudes y las revisiones nacionales (ICR). Además, se requerirá una planificación meticulosa en la preparación de los ensayos para garantizar que todos los idiomas estén listos para lo siguiente:
- Presentación simultánea a través del CTIS
- Cambios y actualizaciones durante los breves plazos de revisión normativos
El sistema se basa en un principio de decisión táctica. Esto significa que, si un promotor no responde dentro del plazo de una solicitud de información de las autoridades de un Estado miembro, la solicitud caducará en todos los demás Estados miembros involucrados.
Los modelos lingüísticos de gran tamaño (LLM) y los servicios de IA para el sector biomédico tienen el potencial de agilizar considerablemente las traducciones de ensayos clínicos y garantizar, al mismo tiempo, la coherencia en grandes volúmenes de contenido. En particular, la calidad de las traducciones con LLM está mejorando a gran velocidad. Los promotores de ensayos pueden utilizar las ventajas de las soluciones de IA y combinar una buena estrategia lingüística con LLM y niveles predeterminados de intervención humana. (También reducirán con ello el riesgo). Se pueden diseñar estrategias de este tipo a más niveles, como se indica a continuación.

Póngase en contacto con nosotros
¿Necesita asistencia para elaborar una estrategia para la traducción del sector biomédico? ¿Le gustaría conocer mejor las soluciones basadas en IA para el sector biomédico? Lionbridge cuenta con décadas de experiencia y especialización en traducción para ensayos clínicos. Póngase en contacto con nosotros hoy mismo e infórmese sobre todo lo que Lionbridge le puede ofrecer como proveedor de servicios lingüísticos para el sector biomédico.
