语言:
- 我们的服务范围
- 人工智能

- 行业

内容服务
- 技术文献写作
- 培训和在线学习
- 财务报告
- 数字营销
- 搜索引擎优化 (SEO) 和内容优化
翻译服务
- 视频本地化
- 软件本地化
- 受监管内容翻译与本地化
- 口译
- 现场活动
- 网站本地化
测试服务
- 功能 QA 和测试
- 兼容性测试
- 互操作性测试
- 性能测试
- 辅助功能测试
- UX/CX 测试
解决方案
- 翻译服务模式
- 机器翻译
- Smart Onboarding™
Lionbridge 知识中心
- 改善患者治疗结果
- 本地化的未来
- 将创新想法转化为免疫实践
- 新冠肺炎疫情资源中心
- 颠覆系列
- 患者配合度
- Lionbridge 见解
选择语言:
在我们最新的新冠肺炎疫情系列博客文章中,Lionbridge 专家就疫情期间和未来的临床开发和监管审批生态系统发表了观点。
Lionbridge 业务规模可观,拥有全套语言、沟通和技术解决方案且服务卓越,严阵以待,助力疫苗和治疗方案进入市场。
本文数据更新于 2020 年 12 月 7 日,星期一。
新冠肺炎疫苗研发竞赛
在新冠肺炎疫苗竞赛中,要想不掉队,就要积极投身其中。疫苗候选菌株的研发速度之快令人咂舌,相比之下,新治疗方法的探索就相形见绌了。竞赛仍在进行,确诊与死亡人数不断攀升,因此全球医疗行业的利益相关者需要戮力同心,全力以赴。根据世界卫生组织 (WHO) 的数据,全球已有超过 6,600 万人确诊,150 多万人死亡,而且这一数字仍在不断攀升。
竞赛进行到现在,全球范围内应对新型冠状病毒 (SARS-CoV-2) 的临床管线正在进行 1,157 项试验,至少 100 种疫苗正处于研发过程中。11 月 20 日,美国辉瑞和德国生物新科技联合发布消息 称将向美国食品和药物管理局 (FDA) 提交其疫苗候选菌株 BNT162b2 的紧急使用授权 (EUA)。11 月 25 日,Moderna 宣布欧盟委员会已批准了一项 8,000 万支 mRNA-1273 疫苗候选菌株的预购协议。
其他疫苗候选菌株目前正处于研发管线后期,包括阿斯利康 (AstraZeneca) 与牛津大学联合研发的疫苗 AZD1222 和中国康希诺生物 (CanSino Biologics) 研发的基因重组疫苗 Ad5-nCoV。

提速保质
紧迫感和巨变通常是击败紧急威胁最有效的应对机制,在这次疫情中也不例外。出色运营和虚拟临床试验对研发新型新冠肺炎疫苗来说大有裨益,疫情的紧急性和严重性也不容许疫苗质量出现瑕疵。
全球监管机构也在加快提供科学建议和批准紧急使用授权。与此同时,监管机构也已强调,疫苗要想通过监管审查,数据就必须保质保量。
FDA 发布的十月指导方针《新冠肺炎预防疫苗的紧急使用授权》解决的正是面前的质量问题。仅当机构确定“根据至少一次且设计完备的 3 期试验数据(以清晰、有说服力的方式阐释疫苗疗效和安全性),疫苗利大于风险”时,才会授予 EUA。
在安全性、疗效和质量之间谋求持续平衡
在当前新冠肺炎疫苗的临床研发管线中,我们可以看到数量可观的 3 期试验在数百个试验点招募了多达 40,000 名参与者,并在短时间内开展了试验。仅在开展疫苗候选菌株 (BNT162b2) 1/2 期安全性和免疫原性试验三个月后,辉瑞就启动了该疫苗的 2/3 期安全性和疗效试验。仅在通过 FDA 审批两小时后,辉瑞就为首位试验参与者注射了第一支疫苗。
截止到 11 月23 日,俄罗斯已有两种疫苗通过了审批。然而,这两种疫苗均在 3 期试验前就获得了俄罗斯卫生部的批准。疫苗专家对普京在 8 月发布的声明表示担忧,他们认为如此加快监管流程“太过愚蠢”、“恐怖且风险非常高”。
药物研发要始终在安全性、疗效和质量之间谋求平衡,这场疫苗竞赛需要兼顾数据完整性和可靠性。
从竞争到携手合作:与时间赛跑
疫情期间,通常在创新疗法上市方面互相竞争的行业参与者展现出了罕见的合作精神。制药企业开始共享通常严密保护的专有技术和专业知识,以便加快新冠肺炎疫苗研发。
互为竞争对手的全球两大疫苗制造商巨头 GSK 和 Sanofi 的携手正体现了这种合作精神。GSK 向 Sanofi 授权了佐药技术,此技术搭配 Sanofi 的疫苗候选菌株,可增强免疫反应并减少每支疫苗的有效剂量。鉴于当前疫情且合作双方向美国政府承诺供应 1 亿支疫苗,这种强强联合将起到至关重要的作用。
多管齐下:多期试验同步进行
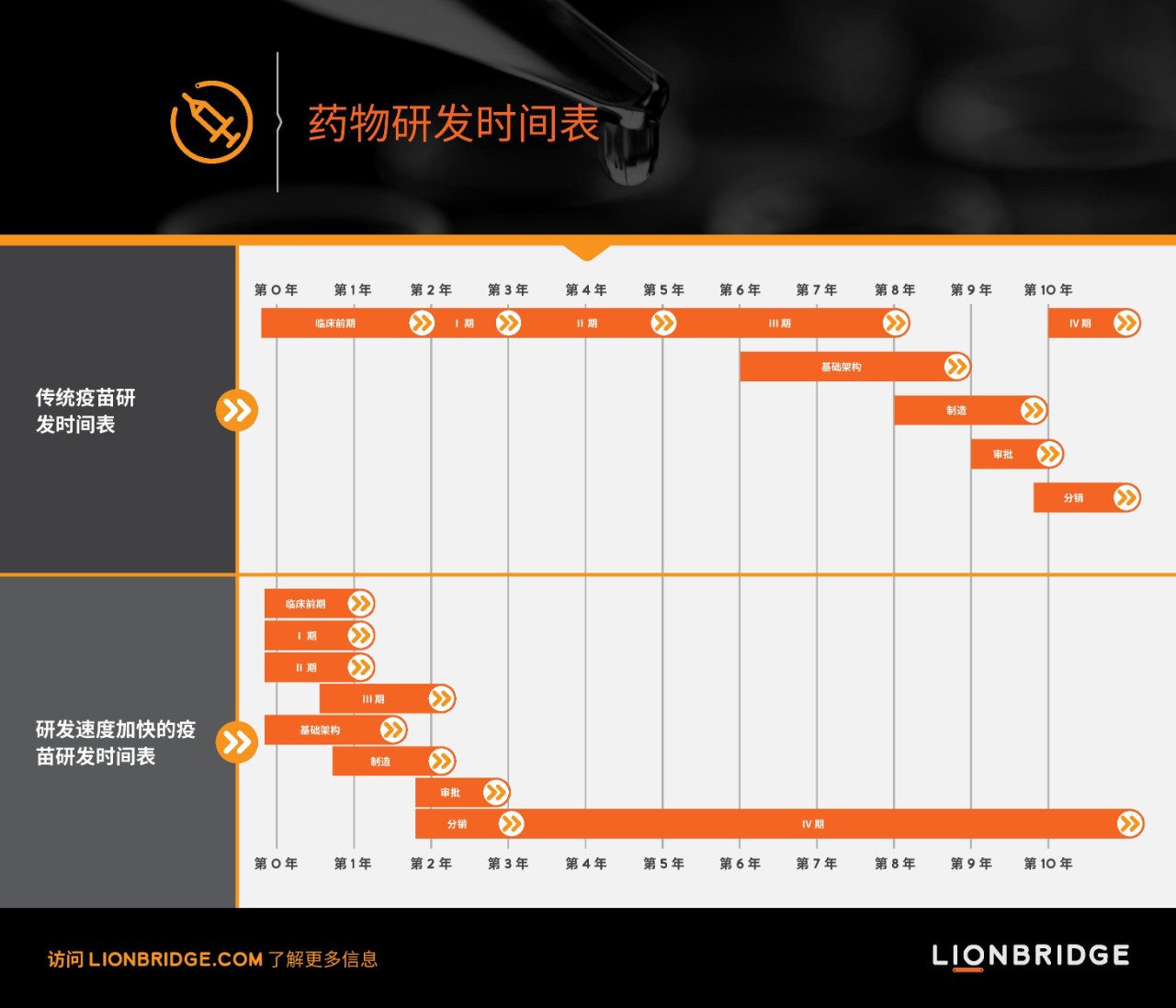
这种研发方式的速度已创新高。
从临床前研究到获得监管许可再到包含数个阶段的临床研发计划,疫苗研发通常要持续十多年时间。当前,新冠肺炎疫苗研发时间缩短是因为采用了并行开展模式。研发采用无间断试验设计,1/2 和 2/3 期同时进行,以便提高研发速度。试验采用多种方式获得结果,涵盖多样化人群和更多的疫苗候选菌株。
例如,在选定 2/3 期首选疫苗候选菌株 (BNT162b2) 前,辉瑞已在 1/2 期同时针对四种疫苗候选菌株开展了试验。美国、阿根廷、巴西、德国、南非和土耳其的 155 个试验点共有约 44,000 名试验参与者登记参与 BNT162b2 的 2/3 期试验。该试验的规模之大不仅限于参与者和试验点数量上,还体现在登记参与实验的群体多样性上。试验开始时,招募的参与者包括三个不同年龄层的成年人,最高年龄 85 岁,不久之后参与者范围到了最低年龄 12 岁的青少年。此外,该疫苗还在慢性 HIV 患者、乙型和丙型肝炎患者身上进行了测试。疫苗的联合研发公司辉瑞和生物新科技预计将在 2020 年生产出多达 5,000 万支、2021 年底生产出 13 亿支疫苗。
新冠肺炎对未来服务模式的影响
新冠肺炎疫情已向大家证明,从实验前期到 3 期结束共计八年的标准研发过程如何缩减至两年,并在短短三年内将疫苗推向市场。研发速度之快已打破纪录。正因如此,现在我们有望在今年年底看到疫苗上市。

还有很多危及生命或罕见的疾病尚无治疗方法,那么这种多个行业、监管机构、政府和医疗组织的国际间通力合作能否提高这些疾病疗法的研发上市速度?为何不让这些疾病的患者也受益于当前疫情下的出色运营呢?这次疫情不但向我们展示了医疗用品的研发和生产可以缩短至数年,也提高了加速试验进程的数字基础设施和工具的采用率,例如电子日志、远程医疗、智能手机和可穿戴设备。
试验进程加快将对整条供应链和服务提供商产生影响,后者将需要提高运营速度和敏捷性以便满足行业和监管机构的要求。对语言服务提供商来说,加快的临床研究和上市授权将影响其服务模式,并且需要其具备敏捷的交付、资源配备和语言能力。语言资产的使用、自动化和可扩展能力将成为提供快速各项服务的基础,而积极的语言质量保证将成为管理风险的有力武器。