语言:
- 我们的服务范围
- 人工智能

- 行业

内容服务
- 技术文献写作
- 培训和在线学习
- 财务报告
- 数字营销
- 搜索引擎优化 (SEO) 和内容优化
翻译服务
- 视频本地化
- 软件本地化
- 受监管内容翻译与本地化
- 口译
- 现场活动
- 网站本地化
测试服务
- 功能 QA 和测试
- 兼容性测试
- 互操作性测试
- 性能测试
- 辅助功能测试
- UX/CX 测试
解决方案
- 翻译服务模式
- 机器翻译
- Smart Onboarding™
Lionbridge 知识中心
- 改善患者治疗结果
- 本地化的未来
- 将创新想法转化为免疫实践
- 新冠肺炎疫情资源中心
- 颠覆系列
- 患者配合度
- Lionbridge 见解
选择语言:
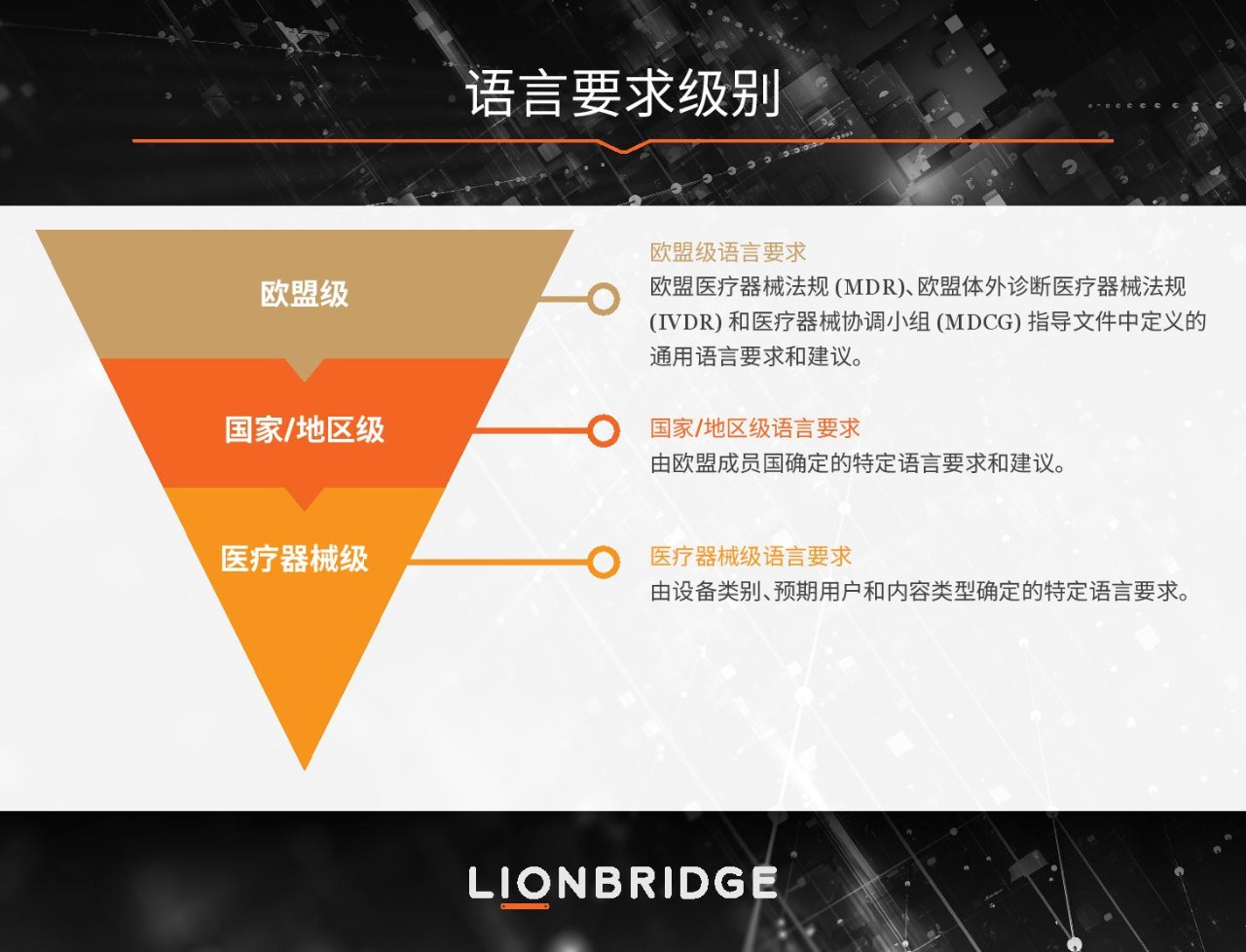
对于希望将医疗器械投放到欧洲市场的医疗器械制造商而言,2017 年 EUR-Lex 新出台的两项欧洲法规为他们带来了翻天覆地的变化。MDR 和 IVDR 取代了上世纪 90 年代的旧医疗器械指令。自 2022 年 5 月 26 日 IVDR 生效之日起,这两项新法规的过渡期便已结束。如今,这两项法规已全面生效。不过,仍有少数器械可能会因“宽限期”延长继续在市场留存。
MDR 于 2021 年 5 月 26 日生效。生效一年来,Lionbridge 一直与医疗技术客户通力合作,以期找到灵活且合适的解决方案,应对这些新监管改革下的要求带来的语言挑战。这一旅程才刚刚开始,但我们会始终致力于帮助客户在整个器械生命周期内集中处理翻译并充分利用语言资产。

这两项法规都对制造商器械产品组合的整个生命周期进行管控,并要求在 EUDAMED 数据库中公开披露器械的性能和安全性数据。对于各医疗技术制造商来说,要想深度了解器械产品组合的语言战略,现在就是理想时机。
对于各制造商来说,MDR 和 IVDR 带来了相似的内容和语言挑战。工作负担增加的来源有二:一是两项法规都在器械的整个生命周期中增加了新的文档要求;二是两项法规都针对投放到欧盟市场的医疗技术提出了新的透明度要求。
Lionbridge 发布了 MDR 系列博客,就制造商如何突破语言障碍持续发表我们的观点和建议。伴随着 IVDR 的生效,我们又发布了全新 IVDR 白皮书,阐述我们对该法规的见解。

我们仍然建议制造商合理规划翻译流程、语言资产以及其他的器械开发和设计控制活动。
欧盟是一个多语言地区。尽管将旧欧盟指令升级为法规主要是为了实现统一性,但语言事务依然归属各成员国主管部门自行处理。我们建议制造商对语言活动进行评估分级,以帮助跨器械产品组合控制和优化语言活动。