LANGUE :
- CE QUE NOUS FAISONS
- IA
Pôles de connaissances Lionbridge
- Résultats positifs pour les patients

- SECTEURS

Services de contenu
- Rédaction technique
- Formation et eLearning
- Reporting financier
- Marketing numérique
- Optimisation de contenu
Services de traduction
- Localisation vidéo
- Localisation de logiciels
- Localisation de site Web
- Traduction certifiée
- Interprétation
- Événements en direct
Services de tests
- Assurance qualité fonctionnelle et tests
- Tests de compatibilité
- Tests d'interopérabilité
- Test des performances
- Tests d'accessibilité
- Test utilisateur/client
Solutions
- Modèles de services de traduction
- Traduction automatique
- Smart Onboarding™
Nos pôles de connaissances
- Résultats positifs pour les patients
- Futur de la localisation
- De l'innovation à l'immunité
- Centre de ressources pour la COVID-19
- Série Disruptive
- Engagement patient
- Lionbridge Insights
Sciences de la vie
- Pharmaceutique
- Clinique
- Réglementaire
- Post-approbation
- Entreprise
- Dispositifs médicaux
- Validation et clinique
- Réglementaire
- Post-autorisation
- Entreprise
Banque et finance
Vente au détail
Luxe
E-commerce
Lionbridge Games
Automobile
Biens de Consommation
Technologie
Fabrication industrielle
Services juridiques
Tourisme
SÉLECTIONNER LA LANGUE :
Je ne connais pas une seule personne possédant une expérience dans l'industrie pharmaceutique qui oserait affirmer que le processus réglementaire est simple.
Découvrez comment réduire la complexité.
Le paysage actuel de la recherche clinique est particulièrement étendu et le nombre d'essais effectués dans le monde augmente chaque année. Il existe actuellement 284 522 études menées dans 204 pays à travers le monde. Ce contexte suscite l'enthousiasme : plus d'innovation engendre davantage de solutions pour traiter un nombre accru de maladies, destinées à davantage de populations. Toutefois, cela entraîne également une complexité croissante dans un marché déjà compliqué.
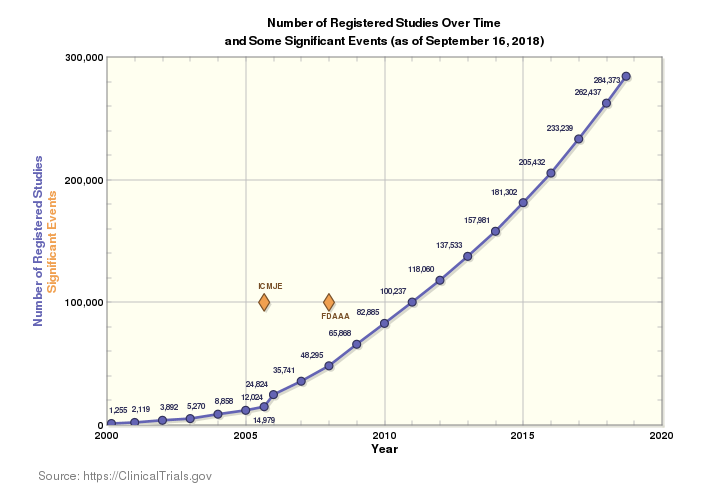
Lorsque vous étendez les essais dans plus de pays et de langues, vous devez respecter un plus grand nombre de règles et de réglementations pour les chaînes d'approvisionnement cliniques. Vous devez également tenir compte d'un nombre plus élevé de personnes. Cet argument, associé à la pression constante de devoir réduire les délais de mise sur le marché, les coûts et d'éliminer les erreurs d'approvisionnement et de livraison, rend la conformité plus compliquée que jamais.
« Conforme » ne signifie pas forcément « compliqué ». Voici trois façons dont les sociétés clairvoyantes réduisent la complexité du processus d'étiquetage clinique.
1. Créez une base de données certifiée pour les traductions et le contenu réglementaire.
Le processus de préparation des étiquettes cliniques d'une manière qui garantit à la fois précision et conformité est principalement manuel. Plusieurs contacts doivent examiner la documentation avant sa diffusion, de nombreux fournisseurs ont des opinions et des perspectives divergentes et diverses parties affichent des préférences différentes pour les traductions, ce qui peut conduire les entreprises pharmaceutiques à « réinventer la roue » chaque fois qu'elles sont soumises à une nouvelle initiative d'étiquetage clinique.
Des bases de données certifiées pour les traductions et le contenu réglementaire, avec notamment des bibliothèques de phrases cohérentes et exhaustives, réduisent la durée du cycle, normalisent le contenu, permettent des changements plus rapides en fin de phase et limitent les risques en préservant la cohérence dans l'ensemble de votre processus international. En un mot : vos produits sont commercialisés plus rapidement, sont moins onéreux et moins exposés.
2. Reposez-vous sur des experts dédiés dans le pays, pas sur vos collègues.
Alors que les entreprises pharmaceutiques s'efforcent d'en faire davantage avec moins de ressources, elles essaient souvent de réduire les coûts et de gérer les réglementations en interne avec des « ressources empruntées ». Mais s'appuyer sur vos collègues pour mener à bien la conformité et le processus d'étiquetage clinique augmente souvent les coûts et la complexité. Pourquoi ? Ce processus « par étiquette » pour la validation et la traduction réglementaires entraîne des délais plus longs, une prévalence d'erreur plus élevée et une difficulté accrue à effectuer le suivi de la conformité.
Les organisations avisées savent qu'investir dans les experts nationaux idoines qui affichent une expertise à la fois réglementaire et linguistique garantit que leur étiquetage est systématiquement fourni avec précision et rapidité. En s'éloignant de l'approche « par étiquette » et en normalisant le processus autour de ces experts, elles diminuent leur profil de risque.
3. Adoptez la créativité contrôlée.
En effet, certaines des meilleures solutions aux problèmes les plus épineux en termes de complexité et d'évolution du paysage réglementaire nécessitent un peu de créativité. Par exemple, votre organisation pourrait minimiser les cycles de modifications et de réétiquetage en débutant tardivement le processus d'étiquetage de manière intentionnelle, ce qui aiderait également à gérer le stockage, la logistique et la durée de conservation. Vous pouvez également accélérer les traductions en utilisant des bibliothèques étoffées de phrases et une technologie linguistique innovante.
Paradoxalement, en essayant de réduire la complexité, ces solutions peuvent engendrer leurs propres complications. Chacune nécessite une conception, un développement et une gestion spécialisés. Si vous souhaitez résoudre vos problèmes de manière globale, systématique et créative, il est souvent plus facile de collaborer avec un partenaire qui peut gérer cette logistique à votre place.
Chez Lionbridge Life Sciences, nous cherchons constamment des moyens d'aider nos clients à surmonter les problèmes qui les empêchent d'obtenir des médicaments efficaces et abordables sur le marché le plus rapidement possible. Pour plus d'informations sur la façon dont vous pouvez surmonter ces problèmes et sur les actions de vos collègues pour résoudre la complexité toujours croissante de l'étiquetage clinique pour l'IMP et l'IND, consultez ce webinaire récent avec Peter Quigley, vice-président de Lionbridge Life Sciences via DIA ou contactez-nous.
#contenus réglementés #entreprises pharmaceutiques #essais cliniques #étiquetage d'essais cliniques #recherche clinique #sciences de la vie

