語言:
- 服務內容
- AI

- 產業

內容服務
- 技術文件編寫
- 訓練與線上學習
- 財務報告
- 數位行銷
- SEO 與內容最佳化
翻譯服務
- 影音內容本地化
- 軟體本地化
- 網站本地化
- 受監管公司適用的翻譯服務
- 口譯
- 現場活動
測試服務
- 功能品管與測試
- 相容性測試
- 互操作性測試
- 效能測試
- 輔助使用性測試
- 使用者體驗 / 客戶體驗測試
解決方案
- 翻譯服務模式
- 機器翻譯
- Smart Onboarding™
我們的知識中心
- 理想的病患治療結果
- 本地化的未來
- 將創新力轉為免疫力
- COVID-19 資源中心
- 產業動盪系列
- 病人參與
- Lionbridge 深入見解
選擇語言:
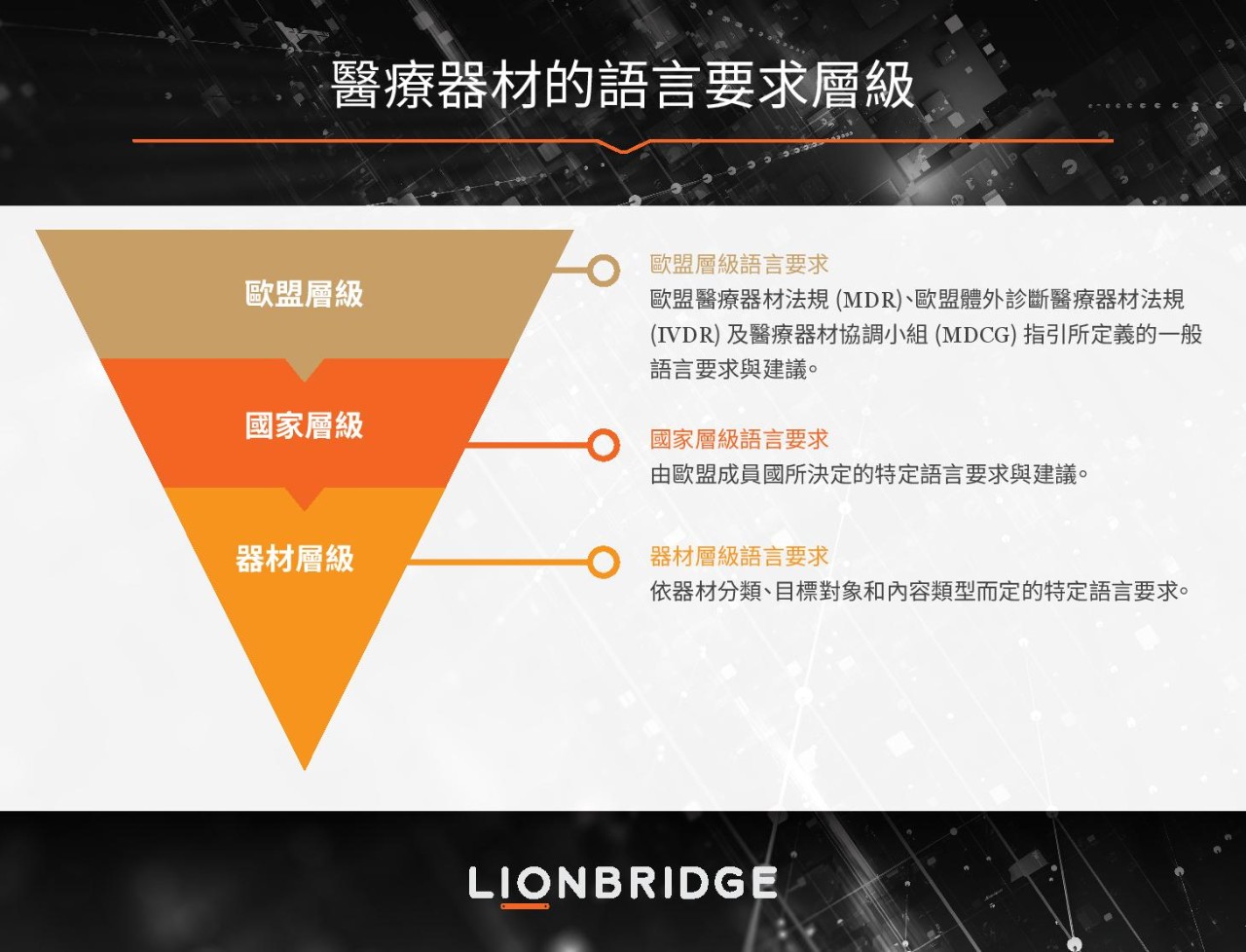
對於想在歐盟市場推出醫療器材的醫療器材製造商而言,2017 年於 EUR-Lex 網站上發布的兩個歐盟新規範,可說是為他們帶來了海嘯一般的滔天巨浪:歐盟宣布以醫療器材法規 (MDR) 及體外診斷醫療器材法規 (IVDR),取代自 1990 年代起便實施的舊有醫療器材指令。而隨著 IVDR 已於 2022 年 5 月 26 日生效,意味著這兩個新規範的過渡期都已結束,兩者現在已全面生效,只剩少數器材屬於例外情況,還可在「寬限期」內於歐盟市場內販售。
2022 年 5 月 26 日同時也是 MDR 生效滿一年的日子。過去一年中,Lionbridge 與醫藥技術 (MedTech) 產業的不少客戶合作,共同尋找合宜且具彈性的解決方案,以妥善因應這些革新的法規要求所產生的語言挑戰。儘管這個艱辛旅程才剛開始,但我們會盡全力協助客戶將翻譯作業集中化,並在整個器材生命週期內善用語言資產。

這兩個法規的管控範圍,涵蓋了製造商之器材產品組合的整個生命週期,更要求業者必須在這段期間,透過 EUDAMED 資料庫公開揭露器材的效能和安全性。因此 MedTech 製造商更應該趁著這個機會,審慎檢視自己整個器材產品組合的語言策略。
MDR 與 IVDR 在內容和語言上為製造商帶來的挑戰可說非常類似。這些沉重的新工作負荷主要來自兩方面:這兩種器材類型的整個生命週期都有更多新的文件要求,而在歐盟市場中應用醫療技術時也必須遵守新的公開透明度要求。
在 Lionbridge 的 MDR 系列文章中,我們持續地就製造商應如何解決語言障礙等議題,表達了我們的觀點並提出實用建議,也發表了新的 IVDR 白皮書,進一步就 IVDR 提供我們的深入見解。

我們仍然建議製造商應做好翻譯和語言資產的規劃,並配合進行其他的器材開發與設計管制活動。
歐盟是個語言多元的地區。儘管法規調合是將舊版歐盟指令升級為新版規範的主要原因之一,但語言仍舊是由個別歐盟成員國主管機關自行決定與規範的事務。我們鼓勵製造商將語言評估工作分級,這會有助您控管與最佳化整個器材產品組合的語言活動。