語言:
- 服務內容
- AI

- 產業

內容服務
- 技術文件編寫
- 訓練與線上學習
- 財務報告
- 數位行銷
- SEO 與內容最佳化
翻譯服務
- 影音內容本地化
- 軟體本地化
- 網站本地化
- 受監管公司適用的翻譯服務
- 口譯
- 現場活動
測試服務
- 功能品管與測試
- 相容性測試
- 互操作性測試
- 效能測試
- 輔助使用性測試
- 使用者體驗 / 客戶體驗測試
解決方案
- 翻譯服務模式
- 機器翻譯
- Smart Onboarding™
我們的知識中心
- 理想的病患治療結果
- 本地化的未來
- 將創新力轉為免疫力
- COVID-19 資源中心
- 產業動盪系列
- 病人參與
- Lionbridge 深入見解
選擇語言:
產品資訊
資料來源:歐洲藥品管理局
語言是正確使用處方藥的重要媒介
語言是藥品標示中極為重要的一環。因為翻譯不當的標示可能造成不堪設想的後果,而且歐盟市場共有超過 24 種官方語言。標示錯誤不僅會對病人的健康帶來風險,更會讓藥品製造商因標示缺乏正確性和一致性而被究責。在語言審查流程中,如果歐盟成員國的審查人員判斷翻譯品質不甚理想,就有可能延誤歐盟執委會諮詢程序,也就是藥品授權且獲准進入歐盟市場前的最終步驟。
美國國家醫學圖書館的研究結果顯示:高達 33% 的醫療錯誤,都源於包裝和標示的混淆不清。不過,該研究並未說明這種混淆究竟是起因於標示的來源語言,還是其他語言的翻譯內容出了差錯。
但可以確定的是:語言本身具有相當程度的主觀性,除了富含文化或專業層面的慣例,也容易發生誤解,原因在於語言和意義的處理過程,都要在資訊接收者的所處情境和技術範疇內進行。語言審查流程不僅是法規標示中的重要品質步驟,更攸關多語系的歐盟地區能否正確使用藥品。
中央授權核准是進入整個歐盟市場的門票
如同歐盟臨床試驗規範 726/2004 所定義,集中審查程序 (CP) 是一項強制性的法規監管時程,專門為歐盟的許多新藥產品進行授權。在這些藥品當中,有些含有用於重要適應症 (例如癌症、糖尿病、自體免疫和病毒性疾病) 的嶄新有效成分,有些則透過生物技術流程和單株抗體方法研發而成。
上述「強制性」藥品,都是未獲解決之重大/新興病人需求及科學創新下的成果,但在這些藥品之外,許多試驗委託者也需透過集中審查程序取得核准。唯有如此,他們才能憑藉單一申請書,受惠於經歐盟成員國彼此同意的法規標準,並進入整個歐盟市場。畢竟,歐盟成員國的法規協調不僅能讓病人取得治療介入方法,也能加快試驗委託者的上市速度。

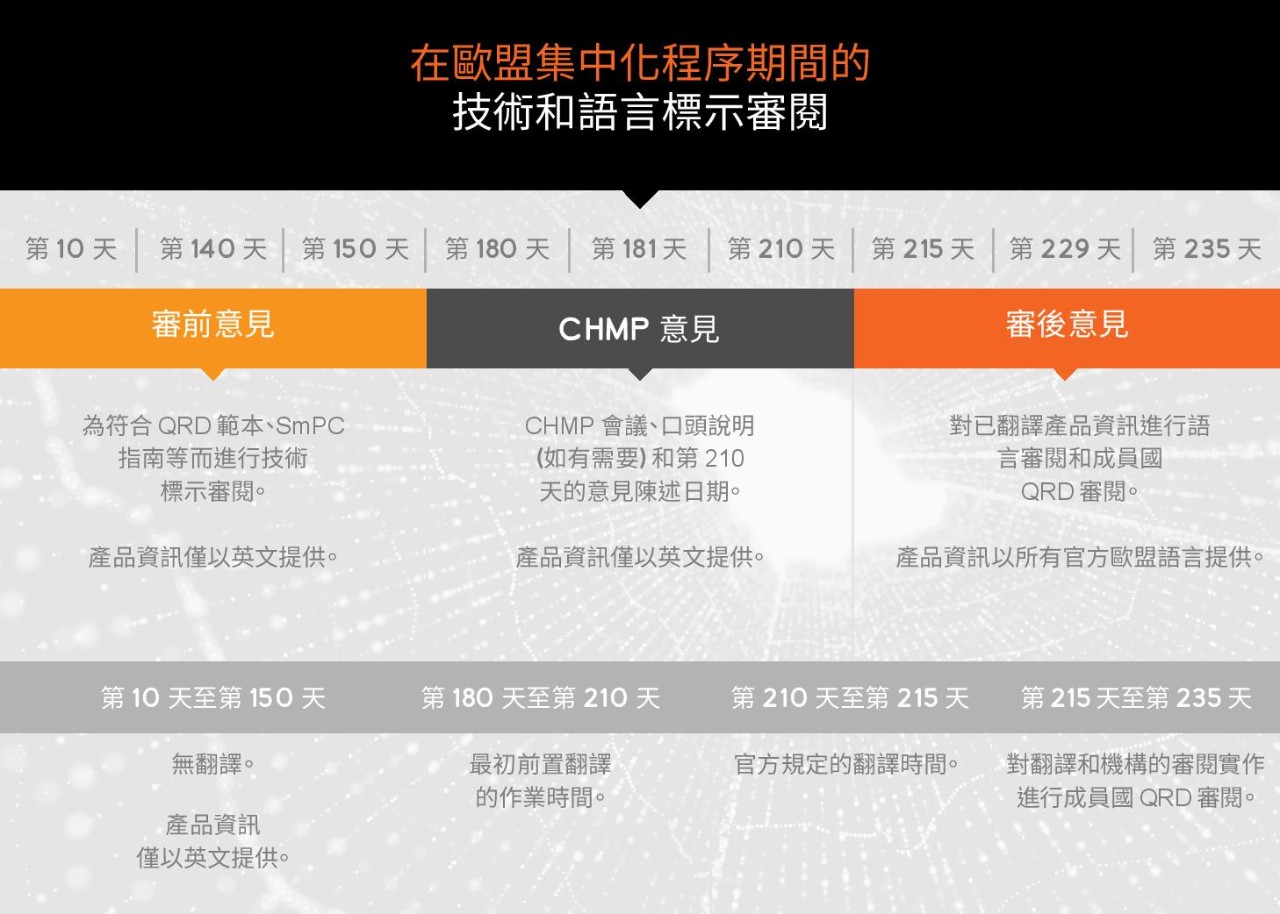
語言審查流程是法規要求之一
語言審查流程歐洲獨有的制度,旨在呼籲各方審慎與語言服務供應商合作,這些供應商不只要專精於歐盟標示語言法規要求,在法規文件品質審查 (QRD) 也必須深具經驗。新藥品申請和藥品延展都需進行相同的語言審查流程。不過,授權後的藥品變異版本是否應進行語言審查流程,則需視變動類型而定。語言審查流程也涵蓋重新評估、更新、轉介和安全性程序等面向。
語言審查會由每個歐盟成員國所任命的國家級 QRD 成員負責執行,旨在依據下列條件審查翻譯品質。
QRD 翻譯審查
- 漏字或遺漏句子
- 科學內容翻譯發生錯誤 (例如術語有誤)
- 誤譯 (翻譯錯誤,包括拼字、標點符號和文法錯誤)
- 編輯和樣式變更 (例如改寫)
- 格式
QRD 審查人員駁回翻譯並退回給申請人時,必須說明申請人提出的翻譯為何不被接受。儘管這種情況相當少見,然而這也足以證實語言本身具有相當程度的主觀性,即便是 QRD 審查人員,也難以摒除自身的語言偏好。
當法規審查人員對翻譯品質表達出疑慮時,具語言專業能力的語言服務供應商可助試驗委託者一臂之力,協助對方與相關審查人員進行互動。

所需時間和合作夥伴關係將成為一大關鍵
語言審查流程需遵守嚴格的法規時程。在翻譯上,官方僅給予 5 天的法規翻譯時間,相當緊迫。畢竟,需要取得歐盟授權的語言種類繁多,而招募和協調超過 24 種語言的高品質譯者,需耗費極大的心力。正因如此,翻譯應在進入官方意見徵詢之前便展開作業,時程上應盡可能接近專屬銷售期 (「Day 180」),並要先解決懸而未決的主要問題。
許多人認為:技術是成功且及時完成標示翻譯的重要關鍵。但我們認為:在語言審查流程期間,無論試驗委託者或供應商端,都需仰賴眾多人力資源和審閱人員所提供的頂級服務,而此一強大合作夥伴關係所展現的價值,是無法由技術取而代之的。
Lionbridge 可確保全球各地的人士都能清楚理解您藥品的產品標示內容,包括處方資訊、供醫療照護專業人士和法規管理人員檢視的產品特性概述 (SPC)、包裝標示和仿單等。我們能為您驗證標示,確保內容的正確性與完整性,並符合每個目標市場和語言的法規要求。
身為法規翻譯專家,Lionbridge 不僅能翻譯試驗用藥、安慰劑、對照用藥或臨床試驗計畫書評估指標所使用的輔助藥品,還可驗證其一次、二次和/或三次標示,同時協助您根據 GMP 標準的要求,為所有市場製作正確並符合法規的藥品標示。
與我們聯絡
若想了解 Lionbridge 生命科學服務如何協助您因應法規標示的翻譯與本地化需求,歡迎立即與我們聯絡。