語言:
- 服務內容
- AI

- 產業

內容服務
- 技術文件編寫
- 訓練與線上學習
- 財務報告
- 數位行銷
- SEO 與內容最佳化
翻譯服務
- 影音內容本地化
- 軟體本地化
- 網站本地化
- 受監管公司適用的翻譯服務
- 口譯
- 現場活動
測試服務
- 功能品管與測試
- 相容性測試
- 互操作性測試
- 效能測試
- 輔助使用性測試
- 使用者體驗 / 客戶體驗測試
解決方案
- 翻譯服務模式
- 機器翻譯
- Smart Onboarding™
我們的知識中心
- 理想的病患治療結果
- 本地化的未來
- 將創新力轉為免疫力
- COVID-19 資源中心
- 產業動盪系列
- 病人參與
- Lionbridge 深入見解
選擇語言:
在最新的 COVID-19 系列文章中,Lionbridge 專家就疫情全球大流行期間以及未來的臨床研發與法規許可的生態系統,提供了相關的實用觀點。
規模與卓越能力兼具的 Lionbridge,擁有完善一套語言、通訊和技術解決方案,能為任何想加快腳步推出疫苗與攸關性命治療的客戶提供所需的支援。
本文中的統計數據為 2020 年 12 月 7 日的資料。
COVID-19 疫苗競賽
COVID-19 病毒疫苗開發的進展之快,世人無不嘖嘖稱奇。候選疫苗的開發以前所未見的速度衝刺,使得以往新治療的標準開發時程看來無比緩慢。但全球醫療體系所有相關人士之所以如火如荼地展開行動,是因為疫情日益嚴重,造成全球死亡人數不斷攀升的緣故。根據 WHO 的統計,這場全球疫情已經造成超過 150 萬人死亡,6600 萬人確診,而且這兩個數字至今仍上升不輟。
在這場與疫情的對抗賽中,全球已有 1,157 個關於 SARS-CoV 傳染病治療的臨床試驗,研發中的疫苗更有至少 100 款。11 月 20 日,輝瑞 (Pfizer) 與 BioNTech 發布新聞稿,表示要向美國食品藥物管理局 (FDA) 申請候選疫苗 BNT162b2 的緊急使用授權 (EUA)。而在 11 月 25 日,莫德納 (Moderna) 也宣布歐盟執委會已通過了預採購合約,將購買 8 千萬劑該公司的候選疫苗 mRNA-1273。
其他進入進程最後階段的候選疫苗,還包括阿斯特捷利康 (AstraZeneca) 與牛津大學合作研發的 AZD1222,以及中國藥廠康希諾生物 (CanSino Biologics) 研發的重組疫苗 Ad5-nCoV。

即使速度加快,也要維護品質
面對緊急威脅時,急迫感以及劇烈的變革往往是與之抗衡最有力的辦法,這次的全球疫情也不例外。卓越的營運能力以及虛擬試驗的執行,都在 COVID-19 新疫苗的研發中發揮了作用,而疫情的緊急程度與嚴重性,更不容在品質上有任何妥協。
全球各地的監管機構都提供了加快處理科學建議與緊急使用授權的管道,但這些主管機關也同時強調,研究資料在質與量上都必須足以令人信服,才能取得相關的法規許可。
FDA 在 10 月時公布的「COVID-19 預防疫苗之緊急使用授權」(Emergency Use Authorization for Vaccines to Prevent COVID-19) 指引中,便直接說明了他們對品質方面的要求。只有「根據至少一個設計良好的第三期臨床試驗結果,清楚明確地證明疫苗的療效與安全性,進而可以判斷疫苗的效益超過其風險」時,該局才會核發 EUA。
全程必須在安全性、療效與品質間求取最佳平衡
在目前 COVID-19 疫苗的臨床進程中,可以看到不少招募多達 40,000 名參加者、試驗單位數以百計的大規模第三期試驗,而且是以令人驚訝的速度展開。以輝瑞的候選疫苗 (BNT162b2) 為例,他們開始第一/二期的安全性與免疫原性試驗後僅三個月,就接著進行了第二/三期的安全性與療效試驗。而在 FDA 授予許可後僅兩小時,輝瑞就為第一位臨床參加者施打了第一劑疫苗。
在俄羅斯,截至 11 月 23 日為止,當局已經批准了兩種疫苗。不過,俄羅斯衛生部 (Russian Ministry of Health) 授予許可時,這兩款疫苗其實都還未進入第三期試驗。因此,總統普丁在 8 月宣布此項消息後,疫苗專家們反而表達了擔憂與質疑,認為這樣的監管加速作法「極為愚蠢」,同時「非常令人害怕,也非常危險」。
藥物的研發全程都要在安全性、療效與品質間求取最佳平衡,因此,在這場疫苗開發競賽中加速前行的同時,也必須要維持資料的完整性與可靠性。
從競爭到合作:與時間賽跑
產業中的公司與企業原本都是競爭對手,無不想方設法希望搶在對手之前推出創新的治療並且上市;然而在疫情大流行期間,他們卻展現了非比尋常的協同合作成果。為了快速研發 COVID-19 疫苗,製藥公司也開始分享原本僅供公司內部使用的專利技術和專業能力。
GSK 與賽諾菲 (Sanofi) 的合作關係就是個很好的例子。這兩家全球頂尖的疫苗製造商,長期以來都是競爭對手,但 GSK 現已提供其佐劑技術供賽諾菲的候選疫苗使用,兩者相輔相成不但能提高免疫反應,亦可降低每劑疫苗所需的劑量。有鑑於疫情的嚴重程度,以及合作雙方承諾將提供美國政府多達 1 億劑的疫苗,這樣的改善成果可謂至關重要。
齊步跑:同時並行的試驗階段
這樣的疫苗開發速度,前所未見。
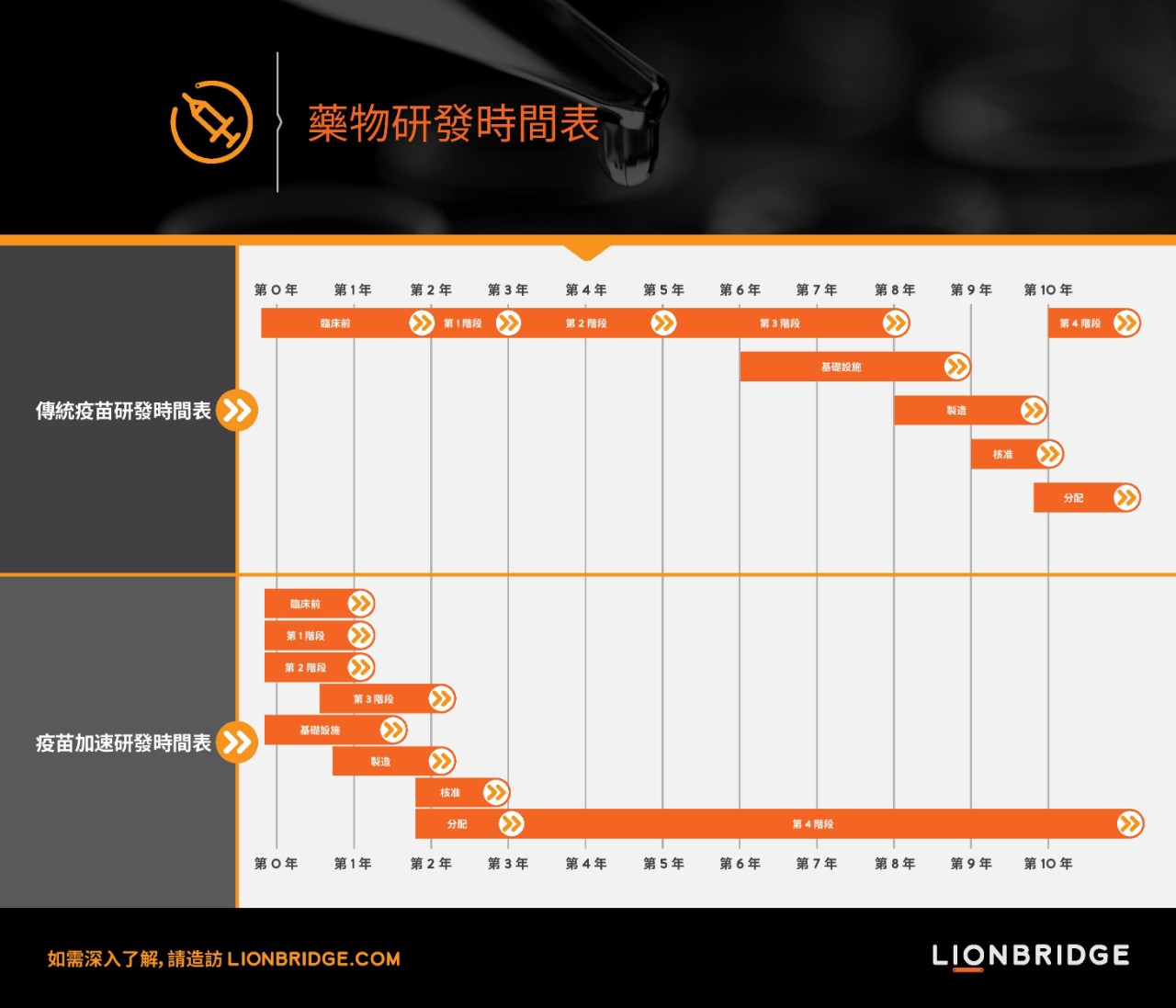
一般而言,從探索可能選項、監管機關許可,一直到依序執行不同階段的臨床開發計畫,疫苗的研發往往需要至少十年。而我們目前看到的 COVID-19 疫苗加速開發作法,是採用平行執行的模式,透過結合第一/二期與第二/三期、順暢銜接的試驗設計,加快開發進程的腳步。這類試驗會包含多個結果指標、多種人口組成,以及更多候選疫苗。
舉例來說,輝瑞就在第一/二期的試驗中同時評估四個候選疫苗,然後挑選表現最好的候選疫苗進行第二/三期試驗 (BNT162b2)。而 BNT162b2 的第二/三期試驗,更在美國、阿根廷、巴西、德國、南非和土耳其的 155 個試驗單位,招募了約 44,000 名參加者。這個試驗不僅在參加者人數和單位數目上規模龐大,納入試驗的人口組成也非常多樣。該試驗一開始招募了最大至 85 歲、分屬三個不同年齡層的成人,稍後又進一步擴大範圍,納入最小至 12 歲的青少年。除此之外,他們也對患有人類免疫缺陷病毒 (HIV)、B 型或 C 型肝炎的慢性病患者進行疫苗試驗。這款疫苗是由輝瑞與 BioNTech 共同開發,他們希望能在 2020 年生產 5 千萬劑疫苗,在 2021 年底生產 13 億劑疫苗。
COVID-19 對未來服務模式的影響
COVID-19 疫情使我們了解到,從臨床前試驗一直到第三期結束這個原本需要八年的標準開發時間,可以大幅縮短到兩年,使得疫苗只需三年就可以上市。這樣的疫苗開發速度可謂前所未見,也正是疫苗有望在今年底開始供應的原因。

這次橫跨產業、監管機關、政府機構與衛生組織,史無前例的國際合作,是否會激勵我們日後在其他攸關性命或沒有治療方法的罕見疾病上,也以同樣作法快速進行臨床試驗?這次因應全球疫情而生的卓越營運能力,有沒有辦法幫助這些病患?這場全球疫情不但證明了,開發與生產的腳步可以加快到只需數年即可,同時也大幅提高了數位基礎設施與工具的使用,像是電子日誌、遠程醫療以及智慧型手機與穿戴式裝置等,都確實有助加快試驗的執行。
這種加速執行的趨勢,也將對整個供應鏈與服務供應商產生深遠影響,因為他們也必須以更快速、更敏捷的方式營運,來滿足產業以及監管機構的要求。對語言服務供應商來說,臨床研究與上市授權速度的加快也同樣會影響到服務模式,他們需要以更敏捷的表現,展現優異的交付、資源開發以及語言能力。語言資產、自動化以及擴充能力的運用,以及更勤奮地透過語言品管控管相關風險,將會是快捷服務套裝方案不可或缺的骨幹基礎。