LINGUA:
- SERVIZI OFFERTI
- IA
Hub di conoscenze Lionbridge
- Risultati positivi per i pazienti
- Il futuro della localizzazione
- Dall'innovazione all'immunità

- SETTORI

Servizi per i contenuti
- Redazione di contenuti tecnici
- Formazione e eLearning
- Resoconti finanziari
- Valutazione dell'esperienza digitale
- Marketing digitale
- Ottimizzazione dei contenuti
Servizi di traduzione
- Localizzazione di video
- Localizzazione di software
- Localizzazione di siti web
- Traduzione per aziende soggette a normative
- Interpretariato
- Eventi live
Servizi di testing
- Testing e controllo della qualità funzionale
- Test di compatibilità
- Test di interoperabilità
- Test delle prestazioni
- Test di accessibilità
- UX/CX Testing
Soluzioni
- Modelli di servizio per la traduzione
- Traduzione automatica
- Smart Onboarding™
I nostri hub di conoscenze
- Risultati positivi per i pazienti
- Il futuro della localizzazione
- Dall'innovazione all'immunità
- Centro risorse per il COVID-19
- La serie della crisi
- Interazione con i pazienti
- Approfondimenti Lionbridge
Life Science
- Settore farmaceutico
- Ricerca clinica
- Normative
- Post-approvazione
- Aziende
- Dispositivi medicali
- Convalida e contenuti clinici
- Normative
- Post-approvazione
- Aziende
Settore bancario e finanziario
Distribuzione
Lusso
E-commerce
Lionbridge Games
Settore automobilistico
Beni di consumo confezionati
Tecnologia
Produzione industriale
Servizi per il settore legale
Viaggi e turismo
SELEZIONARE LA LINGUA:
Le valutazioni degli esiti riferiti dai pazienti sono diventate strumenti preziosi per includere la voce del paziente nello sviluppo di prodotti medicali. I dati sugli esiti riferiti dai pazienti possono essere raccolti durante tutto il ciclo di vita dei prodotti, dalle prime fasi di sviluppo fino ai trial clinici e agli studi osservazionali. Gli esiti riferiti dai pazienti possono essere usati come base per:
- Criteri di inclusione
- Valutazione generale
- Valutazione dell'efficacia
- Valutazione della sicurezza nei trial clinici e/o studi sulla sicurezza successivi all'autorizzazione
Le autorità di regolamentazione, come la FDA negli Stati Uniti e l'EMA nell'Unione europea, classificano gli esiti riferiti dai pazienti nella più ampia categoria di "dati sull'esperienza dei pazienti". Tali dati riflettono le esperienze, i punti di vista, le esigenze, le necessità e le priorità dei pazienti durante tutto il loro percorso. Queste autorità ricorrono a iniziative strategiche e documenti di linee guida per promuovere i dati sull'esperienza dei pazienti come componente chiave per lo sviluppo di prodotti e il processo decisionale regolatorio.
Dati sull'esperienza dei pazienti nel processo decisionale regolatorio
Tuttavia, non è ancora stato raggiunto un allineamento completo tra le autorità di regolamentazione e il settore in merito all'uso dei dati sull'esperienza dei pazienti. Nonostante l'FDA dia molta importanza ai dati sull'esperienza dei pazienti, questo report evidenzia come i richiedenti di autorizzazioni per l'immissione sul mercato, i pazienti e gli operatori sanitari non abbiano chiaro in che modo l'autorità usi tali dati quando deve prendere decisioni in merito alle domande per nuovi farmaci convenzionali e biologici. Analogamente, da un workshop multidisciplinare condotto dall'EMA è emerso che gli stakeholder del settore ritengono che l'autorità di regolamentazione dell'UE non apprezzi o non ritenga importanti i dati sull'esperienza dei pazienti.
Per questi motivi, gli stakeholder sono riluttanti a includere tali dati a supporto delle domande di autorizzazione all'immissione sul mercato. In seguito, l'EMA ha specificato che "apprezza e desidera" i dati sull'esperienza dei pazienti come parte delle domande di autorizzazione all'immissione sul mercato.
Per generare dati sull'esperienza dei pazienti che siano pertinenti, sufficienti e affidabili, è necessaria una maggiore trasparenza riguardo all'uso di tali dati nel processo decisionale regolatorio. La trasparenza può essere raggiunta soltanto con una maggiore armonizzazione, tra le diverse giurisdizioni, dei requisiti regolatori per i dati sull'esperienza dei pazienti raccolti nei trial multiregionali. Come proposto dall'EFPIA (European Federation of Pharmaceutical Industries and Associations), il documento M4E dell'ICH presenta il livello appropriato per un allineamento globale su questi requisiti.

Tattiche migliori per la raccolta dei dati sugli esiti riferiti dai pazienti
Anche se gli esiti riferiti dai pazienti sono essenziali per lo sviluppo di prodotti medicali in generale, le incertezze nella regolamentazione non destano probabilmente preoccupazioni per i partecipanti ai trial, almeno nell'immediato. Un problema più urgente è l'onere della risposta, che può nascere in seguito alla richiesta degli esiti riferiti dai pazienti. I fattori che possono contribuire sono vari:
- Numero di questionari relativi agli esiti riferiti dai pazienti in un trial
- Frequenza delle valutazioni degli esiti riferiti dai pazienti
- Numero di voci in un questionario relativo agli esiti riferiti dai pazienti/tempo necessario per il completamento
- Domande ripetitive o simili nei questionari relativi agli esiti riferiti dai pazienti usati in un trial
- Linguaggio poco chiaro
- Scomodità del formato o della modalità di raccolta dei dati sugli esiti riferiti dai pazienti
Per il successo della strategia di raccolta dei dati sugli esiti riferiti dai pazienti in un trial, è necessario prevedere e mitigare l'onere della risposta. Aiyegbusi e i suoi colleghi hanno presentato un breve riepilogo delle principali considerazioni relative alla metodologia per affrontare il problema dell'onere della risposta. Ecco alcuni punti:
- Chiara motivazione per la selezione degli esiti riferiti dai pazienti da usare nel trial
- Calendario delle valutazioni che prenda in considerazione la natura della condizione e gli effetti degli interventi durante il trial
- Supporto tecnologico per il completamento degli esiti riferiti dai pazienti, quando appropriato
- Coinvolgimento dei pazienti fin dalle prime fasi e loro partecipazione alle decisioni relative alla selezione e alla fornitura degli esiti riferiti dai pazienti

Il ruolo dei fornitori di servizi linguistici per migliorare la raccolta dei dati sugli esiti riferiti dai pazienti
Con il diffondersi dei trial clinici multinazionali e l'aumento dell'uso della tecnologia per gli esiti riferiti dai pazienti in formato elettronico (ePRO), spesso gli sponsor dei trial devono modificare i documenti originali. Le modifiche possono includere la traduzione e l'adattamento interculturale in altre lingue (convalida linguistica) o la migrazione dal formato cartaceo a quello elettronico. Testando le versioni modificate con le popolazioni di pazienti target è possibile identificare e risolvere i problemi prima di usare tali versioni in un trial. I vantaggi sono molteplici:
- Offrire ai pazienti l'opportunità di essere coinvolti fin dalle prime fasi e di partecipare alla ricerca clinica e alle decisioni relative agli esiti riferiti dai pazienti.
- Contribuire alla raccolta di dati efficaci e affidabili ottimizzando le valutazioni degli esiti riferiti dai pazienti grazie all'input dei pazienti stessi.
- Ridurre l'onere per i partecipanti ai trial.
- Soddisfare le aspettative probatorie stabilite dalle autorità di regolamentazione con riguardo al processo di modifica degli esiti riferiti dai pazienti per le popolazioni che ne faranno uso durante il trial. Ciò è particolarmente importante quando i dati sugli esiti riferiti dai pazienti verranno usati a supporto delle dichiarazioni riportate sulle etichette dei prodotti.
I fornitori di servizi linguistici specializzati possono agevolare queste prove attraverso procedure come il debriefing cognitivo e i test di usabilità. I test vengono condotti nei paesi di riferimento con un piccolo gruppo di madrelingua delle lingue di destinazione che rappresenti adeguatamente la popolazione target del trial clinico.
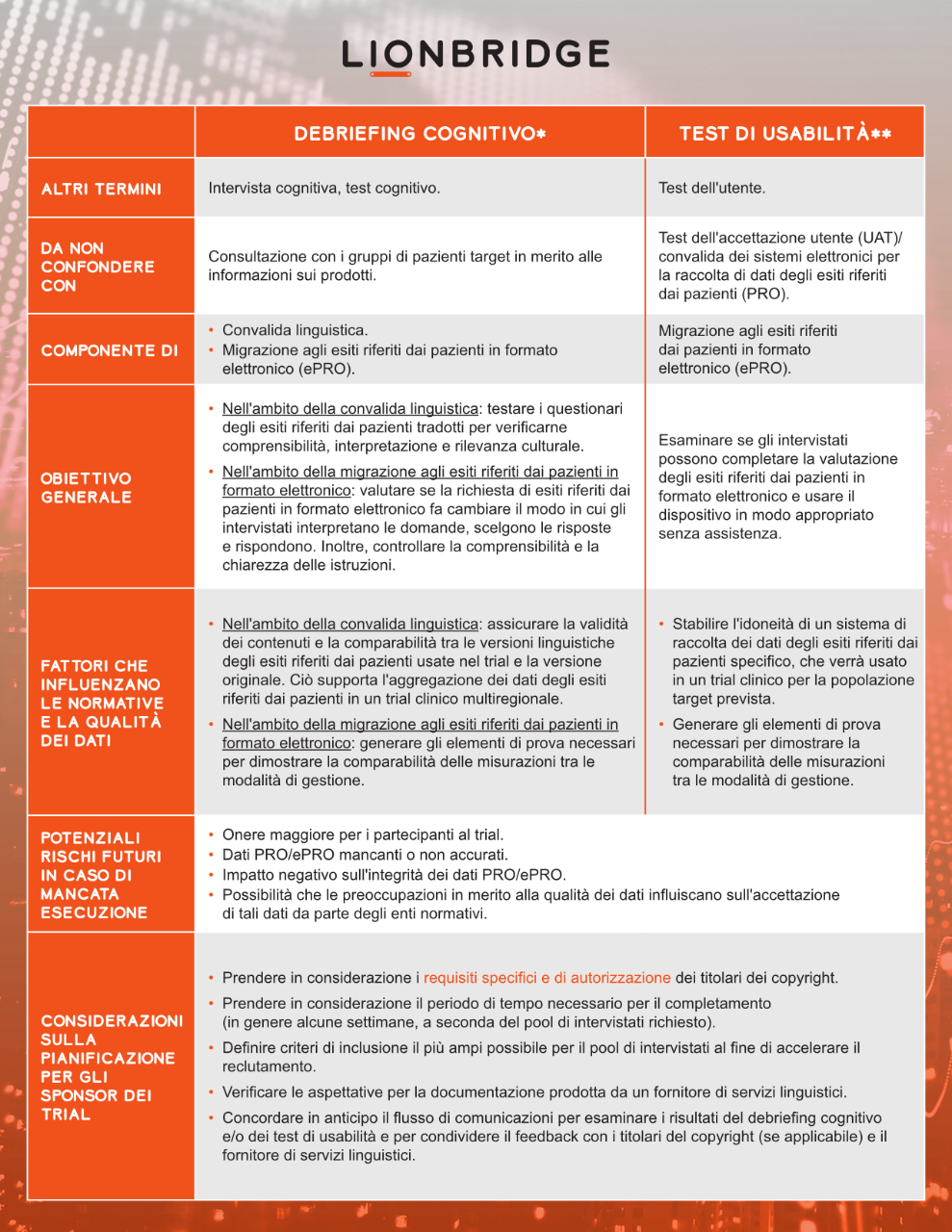
Blog "Diritti di copyright per l'uso di COA nei trial clinici"
* In riferimento a ISPOR Task Force for Translation and Cultural Adaptation e Patient-Reported Outcome (PRO) Consortium
** In riferimento a ISPOR ePRO Good Research Practices Task Force e ISPOR Measurement Comparability Between Modes of Administration of PROMs Task Force
Contattateci
Vi serve assistenza linguistica per la raccolta dei dati sugli esiti riferiti dai pazienti per i trial clinici? Lionbridge ha una profonda conoscenza nell'ambito delle valutazioni dei risultati clinici e una vasta esperienza nei servizi di traduzione per il settore Life Science. Contattateci oggi stesso per saperne di più sul ruolo di Lionbridge come fornitore di servizi linguistici per il settore Life Science.

