語言:
- 服務內容
- AI

- 產業

內容服務
- 技術文件編寫
- 訓練與線上學習
- 財務報告
- 數位行銷
- SEO 與內容最佳化
翻譯服務
- 影音內容本地化
- 軟體本地化
- 網站本地化
- 受監管公司適用的翻譯服務
- 口譯
- 現場活動
測試服務
- 功能品管與測試
- 相容性測試
- 互操作性測試
- 效能測試
- 輔助使用性測試
- 使用者體驗 / 客戶體驗測試
解決方案
- 翻譯服務模式
- 機器翻譯
- Smart Onboarding™
我們的知識中心
- 理想的病患治療結果
- 本地化的未來
- 將創新力轉為免疫力
- COVID-19 資源中心
- 產業動盪系列
- 病人參與
- Lionbridge 深入見解
選擇語言:
凡是有製藥產業相關經驗的人士,都無法否認法規審核流程並不容易。
現今的臨床研究領域不僅十分廣闊,全球的試驗數量也在年年攀升。目前,全球有 204 個國家/地區正在進行 284,522 項研究。這個龐大的數字雖然令人振奮 (畢竟更多的創新,也有助於為更多人提供更多疾病的解決方案),卻也為早已複雜無比的臨床試驗市場帶來更多繁複流程。
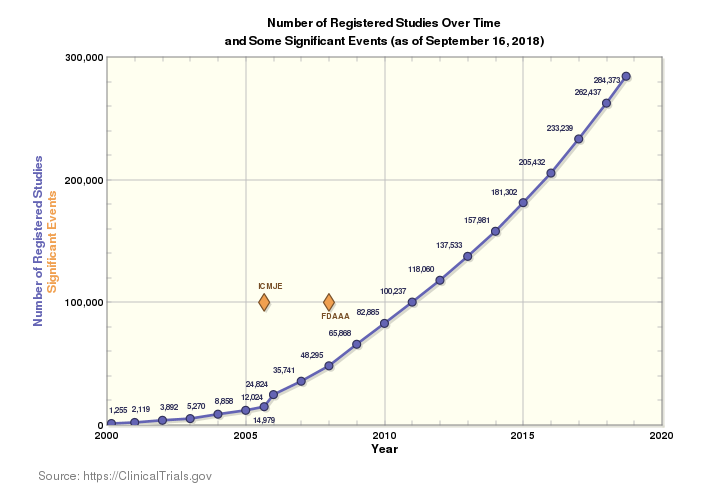
對臨床供應鏈而言,在更多國家/地區使用更多語言進行更多臨床試驗,意味著需要考量更多族群,同時追蹤更多法規。面對這個狀況,以及加快上市時間、降低成本和減少供應與交付錯誤等不變的課題,確保法規遵循的複雜度比以往更複雜。
「法規遵循」一定要和「複雜」劃上等號嗎?答案是未必。讓我們來看看,睿智的公司和組織如何透過以下三種方式,降低臨床標示流程的複雜度。
1.為翻譯與法規內容建立認證資料庫。
臨床標示的準備流程,大多是仰賴人工作業來確保正確性與法規遵循。說明文件輸出前必須由多位聯絡人審閱,眾多廠商抱持著不同的意見與觀點,各方人士也有各自的翻譯偏好,這些因素導致製藥公司在每次新的臨床標示方案上,都得費力從事重複的工作。
有了翻譯與法規內容的認證資料庫 (隨附一致且全面的詞彙資料庫),便可確保全球流程的一致性,進而縮短週期時間、標準化內容、加快晚期變更的速度,並減少風險。如此一來,您就能透過更快的速度、更低廉的成本與更低的曝險度,讓產品順利上市。
2.仰賴專屬的在地專家,而非您的同仁。
由於製藥公司努力以更少的資源完成更多工作,因此他們往往會試圖壓低成本,並運用「人情資源」在內部管理法規。不過,將法規遵循與臨床標示流程工作交給同仁,往往卻「增加」了成本與複雜度。理由何在?這種「依標示」進行法規驗證與翻譯的流程,往往會延長前置時間、提高出錯率,並增加法規遵循情形的追蹤難度。
睿智的組織深知,唯有投入成本、委託兼具法規和語言專才的在地專家,才可確保每次的標示都能正確且快速地完成。在捨棄「依標示」行事的做法,同時將上述專家所涉及的流程標準化之後,風險也會隨之降低。
3.崇尚可控管的創意做法。
有時候,您需要發揮一點創意,才能找出最佳解決方案,解決複雜性日增與法規現況變動所衍生的問題。舉例來說,貴組織可刻意延後標示流程開始的時機,藉此盡可能減少編輯與重新標示的次數,並促進儲存、物流與保存期限的管理,也能運用強大的詞彙資料庫與創新的語言技術,來加快翻譯的速度。
然而矛盾的是,用來降低複雜度的解決方案,也可能是複雜問題的製造者。畢竟,每個解決方案都需要進行專門的設計、開發與管理。如果想透過全面、系統化且創意十足的方式解決您的問題,不妨尋求適當的合作夥伴來為您代勞。
Lionbridge 生命科學團隊不斷努力,尋求各種方式協助客戶克服種種難題,好讓安全、有效且經濟實惠的藥品能盡快上市。歡迎透過 DIA 觀看 Lionbridge 生命科學服務副總裁 Peter Quigley 近期主講的線上研討會或是與我們聯絡,以深入了解如何解決上述難題,並協助同仁因應與日俱增的 IMP 與 IND 臨床標示複雜度。

