언어:
- 서비스 종류
- AI

- 산업 분야

콘텐츠 서비스
- 기술문서 작성
- 교육 및 이러닝
- 재무 보고서
- 디지털 마케팅
- 검색 엔진 최적화(SEO) 및 콘텐츠 최적화
번역 서비스
- 비디오 로컬라이제이션
- 소프트웨어 로컬라이제이션
- 웹사이트 로컬라이제이션
- 규제 관련 기업을 위한 번역
- 통역
- 라이브 이벤트
테스팅 서비스
- 기능 QA 및 테스팅
- 호환성 테스팅
- 상호 운용성 테스팅
- 성능 테스팅
- 액세스 가능성 테스팅
- UX/CX 테스팅
솔루션
- 번역 서비스 모델
- 기계번역
- Smart Onboarding™
라이온브리지 지식 허브
- 긍정적 환자 결과
- 로컬라이제이션의 미래
- 혁신에서 면역으로
- 코로나19 리소스 센터
- 대혼란 시리즈
- 환자 참여
- 라이온브리지 인사이트
언어 선택 :
중국은 전 업계를 통틀어 빠르게 성장하고 있는 대국입니다.
2019년 추정 인구가 14억 2천만 명에 달하는 중국은 앞으로도 계속해서 세계 시장에 파괴적인 영향을 미칠 것으로 보입니다. 그중에서도 가장 강력한 시장은 바로 제약 업계입니다.
중국의 의약품 시장에서는 자국 내에서 더 많은 임상연구와 의약품 출시가 이루어지도록 하기 위한 대대적인 규제 변화가 이루어지고 있습니다. 중국의 국가약품감독관리국(NMPA)은 의약품국제조화회의(ICH)에 가입했습니다. 따라서 이제 중국은 의약품 개발 및 임상시험 수행의 국제적 조화에 기여하기 위해 국제 제약 업계 관리 기준을 준수하고 있습니다.
또한, 중국은 최근 의약품 개발 및 출시를 장려하고 가속화하기 위한 목적으로 규제 체계를 개편했습니다.
이러한 변화들은 단순히 중국뿐 아니라 전 세계의 성장 촉매제가 되고 있습니다.
중국의 의약품 시장에 나타난 규제 변화가 전 세계에 미치는 세 가지 영향은 다음과 같습니다.
1. 중국의 제약 시장 활동이 가속화되면 전 세계 제약 회사들에게도 새로운 기회가 창출된다.
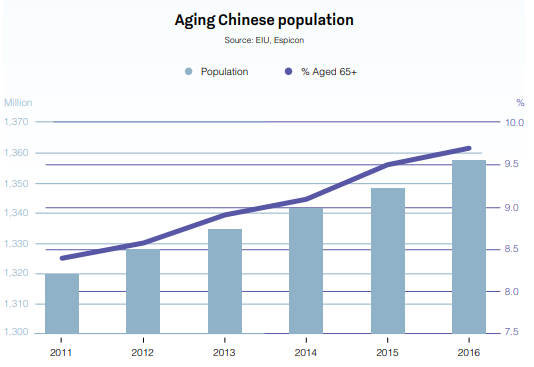
이미 현재 세계에서 두 번째로 큰 5730억 달러 규모의 제약 시장을 둔 중국은 2020년대까지 계속해서 원활하게 성장할 것으로 예상됩니다. 중국은 점차 노화되는 거대 인구, 1인당 소득의 증가, 의료 지출의 증가와 같은 요인들을 발판 삼아 연간 성장률 최대 30%를 기록하기도 했습니다.
출처: Global Business Reports - China Pharmaceuticals 2018
현재 이루어지는 규제 변화는 유망한 신흥 시장에 자사 제품을 판매하길 간절히 바라 왔던 글로벌 제약 회사들에 대한 부담을 덜어주고 있습니다. 중국은 자국에서 수행되는 임상시험에 중국인 환자가 포함되어야 하며 현지 실험실에서 검사가 실시되어야 한다는 의무를 부여하는 규제 요건을 오랜 기간 유지해 왔습니다. 이러한 이유로 제약 회사들은 미국과 EU에서 제품을 출시한 후에만 중국에서 완전히 독립적인 제3상 시험을 실시할 수 있었고 이것은 중국 시장에서의 출시 속도에 제한받지 않기 위한 어쩔 수 없는 선택이었습니다.
그러나 앞으로는 규제 변화와 함께 시험대상자 모집에 아주 적합한 대규모의 치료 무경험 집단이 이용 가능해짐에 따라 미국 및 EU에서의 제품 출시와 동시에 중국에서도 시험을 수행할 수 있는 가능성이 생겼습니다. 따라서 중국인 환자들은 필요한 의약품을 더 빠르게 제공받을 수 있고 글로벌 제약 회사들은 이러한 의약품을 시장에 출시할 기회를 얻을 수 있는, 상호 긍정적인 영향이 나타날 것입니다.
앞으로 몇 년 뒤에는 이러한 체계적 변화가 이루어짐에 따라 중국에 제품을 판매하고자 하는 제약 회사들의 임상 개발 계획과 규제 전략에 어떤 영향이 발생하는지 지켜보는 것도 흥미로운 일이 될 것입니다.
2. 규제 변화는 임상시험의 중복을 줄이고 환자에 대한 불필요한 위험을 낮출 수 있다.
이제 중국은 ICH에 가입했기 때문에 국제 제약 업계에서 널리 용인되고 있는 국제적인 GxP 규격(예: 우수제조관리기준[GMP], 임상시험관리기준[GCP])을 준수하고 있습니다. 이는 의약품 개발 중 중국과 해외 ICH 지역에서 생성되는 임상 데이터가 중국과 전 세계 규제 당국 전반에서 양방향으로 수용된다는 의미이기도 합니다.
이러한 변화는 규제 요건을 조율하고 의약품 개발을 촉진하는 데 있어 중요할 뿐 아니라 환자에 대한 불필요한 위험을 야기하는 임상시험 중복을 예방하는 길이기도 합니다. 중국 규제 체계의 개혁은 현재 전 세계 시장에서 이루어지는 개혁의 모습과 같습니다. 즉, 대중이 새로운 혁신적 치료법을 더 수월하고 더 빠르게 이용할 수 있도록 하기 위한 것입니다.
3. 중국에서 실시되는 임상시험의 양과 속도가 급증할 것이다.
중국의 규제 개편에 따른 한 가지 결과는 분명해 보입니다. 바로 향후 몇 년 뒤면 중국 내에서 실시되는 임상시험의 양과 속도가 급증할 것이라는 점입니다. 중국 규제 당국은 규제 심사의 가속화, 중국으로 수입되는 의약품에 대한 완화된 새 정책의 시행, 특정 제품에 대한 시장 독점 기간 보장(예: 수입 항암제에 대한 관세 면제), 중국 내 임상시험 승인 일정의 대폭 개선을 위한 변화들을 시행했습니다.
현재까지는 중국에서 임상시험 승인을 받으려면 1~3년 정도 소요되었습니다. 이제는 이 기간이 60일(영업일 기준) 정도로 대폭 단축될 것으로 기대됩니다. 이는 이론상 시험 의뢰자가 EU와 중국에서 동시에 신청서를 제출하고 일정을 이행할 수 있음을 의미합니다.
이외에도 NMPA는 출시를 앞당기고 생명에 필수적인 의약품(예: 혁신적 치료제 또는 첨단 기술이나 HIV, 결핵, 간염, 희귀 질환, 악성 종양 같은 질환 또는 소아를 위한 임상적 이점이 상당한 치료제)에 대한 환자 접근을 가속화하기 위해 특정 의약품에 대한 우선순위 심사를 시행 중입니다. NMPA는 또한 시판 허가를 위해 제출되는 해외의 임상 데이터도 새롭게 수용할 계획입니다.
이러한 변화는 새로운 의약품 개발 및 출시를 더욱 활성화하고 의약품 제조업체, 시험 의뢰자 그리고 가장 중요한 환자들을 위한 새로운 기회를 창출할 것입니다.
앞으로도 전 업계의 현명한 기업들은 중국의 행보를 관심 있게 지켜볼 것입니다. 다만, 이처럼 전례 없는 기회를 창출한 제약 업계 규제 변화로 인해 임상시험을 수행하여 중국 시장에 더 빠르고 효율적으로 의약품을 납품하고자 하는 제약 회사들은 중대한 과제 또한 직면하게 되었습니다.
더 짧아진 일정 안에 더 많은 시험을 수행할 수 있게 되었다는 것은 더 많은 콘텐츠 및 더 많은 번역이 필요해짐과 더불어 경험, 국제적 영향력, 확장성을 갖춘 숙련된 파트너가 더욱 절실해졌다는 의미이기 때문입니다. Lionbridge는 지난 수년간 그러한 파트너로 자리매김해 왔습니다. 언제나 그랬듯 당사는 여러분과 함께 같은 목표를 공유하며 더 많은 곳의 더 많은 사람들에게 더 안전한 의약품을 더 빠르게 제공하기 위한 새로운 곳으로의 여정을 함께할 준비가 되어 있습니다. 지금 문의하여 Lionbridge가 중국 및 전 세계 새로운 시장으로 진출하려는 회사를 어떻게 돕고 있는지 알아보세요.

